- 物质的量浓度的计算
- 共63题
11.对于常温下pH为4的醋酸溶液,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.毒胶囊事件中,利用皮革废料制成药用胶囊,导致铬超标。铬是人体必需的微量元素。三价铬是对人体有益的元素,而六价铬是有毒的。
实验一:工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO使六价铬转化为三价铬。实验室中模拟这一过程的装置如下图。
请回答以下问题:
(1)装置A除了能制备CO外,该装置还能用于( )气体的制备(举一例)。
(2)装置B的作用是( )。
(3)写出装置C中反应的化学方程式 ( )。
(4)实验结束时熄灭酒精灯的顺序是________________(填写装置序号)。
(5)该装置一个显著的缺陷是( )。
实验二:重铬酸钾(K2Cr2O7)常用于测定废水中Ba2+浓度,步骤如下:
①取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;
②过滤、洗涤后,用适量稀盐酸溶解.此时BaCrO4全部转化为Cr2O72-;
③再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。
部分反应的离子方程式为:
请回答:
(6)取25.00mL废水时,使用的仪器是( )
A.50mL量筒 B.100mL烧杯 C.酸式滴定管 D.碱式滴定管
(7)该废水中Ba2+的物质的量浓度为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 _____,原因是 _____(写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 ______。
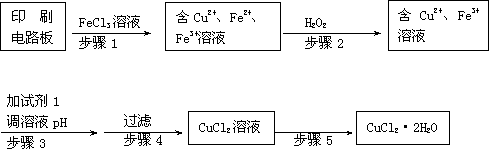
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
①步骤2中反应的离子方程式是________ 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为_______
④步骤3中可选用的“试剂1”是________ (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 ________ [Ksp(Fe(OH)3)=4×10-38]。
正确答案
Ⅰ
湿法炼铜(或方法二) 不会产生污染空气的气体(或湿法炼铜不需要外界提供能量) 3:2
Ⅱ
① 2Fe2++ H2O2 + 2 H+ = 2Fe3+ + 2H2O
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O 
③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。
④ CuO[或Cu(OH)2] 4×10-8mol/L
解析
解析已在路上飞奔,马上就到!
知识点
26.某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:

(1)步骤(a)中,实验研磨孔雀石的仪器名称( );用硫酸浸取的化学方程式:( )
(2)步骤(b)中,pH控制在3.O~3.5,其目的是( );加过氧化氢发生反应的离子方程式为 ( )。
(3)怎样判断蒸发浓缩已完成:( ) 。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表:
写出212~248℃温度范围内发生反应的化学方程式( )。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为( )mol·L-1。
正确答案
(1)研钵 Cu(OH)2·CuC03+2H2S04=2CuS04+3H20+C02↑
(2)使Fe3+沉淀完全,而Cu2+仍留在母液中 2Fe2++H202+2H+=2Fe3++2H2O
(3)当液面有晶体析出时即可说明蒸发浓缩已完成
(4)
(5) 4×lO一6
解析
解析已在路上飞奔,马上就到!
知识点
13.已知常温下Mg(OH)2的Ksp=1.8
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析