- 离子方程式的书写
- 共269题
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
请回答:(1)稀硝酸和Cu反应的化学方程式为_________。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:_________。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
①据实验现象写出发生反应的离子方程式:_________。
②导致实验过程中溶液pH略有上升的可能原因是_________。
③解释乙同学的实验现象
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:_________。
正确答案
见解析。
解析
(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应。
(3)①Cu + 2Fe3+ = Cu2+ + 2Fe2+
②Fe3+ 变为Cu2+和Fe2+,水解能力下降
③在此酸性条件下NO3-不能氧化Cu。
(4)将铜片放入0.5mol/L氯化铁溶液中
知识点
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
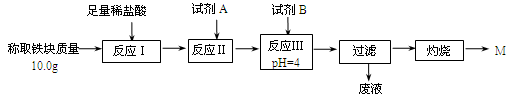
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
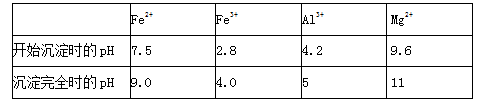
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
① 试剂A应选择 ,试剂B应选择 。(填序号)
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中
c(Fe3+)=1.1×10-6mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
正确答案
解析
略
知识点
9.下列离子方程式不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.某校化学研究性学习小组查阅资料了解到以下内容:
已知乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有少量乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有 (填“氧化性”、“还原性”或“酸性”);请配平该反应的离子方程式:
MnO4-+ H2C2O4+ H+= Mn2++ CO2↑+ H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变
红,据此回答,乙二酸分解的产物为 ,上述装置中,D的作用是
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
(用文字简单表述)
(5)以上溶液中各离子的浓度由大到小的顺序为
(用离子符号表示)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析