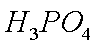- 电离方程式的书写
- 共11题
常温时向

正确答案
解析
略
知识点
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
正确答案
解析
略
知识点
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式________,属于弱酸的电离方程式________。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是________(选填编号)。
a. 气态氢化物的稳定性
b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易
d. 单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为________。
(4) Na2CO3俗称纯碱,属于________晶体。工业上制取纯碱的原料是________。
正确答案
(1)

(2)ac
(3)Al(OH)3+OH-=AlO2- +2H2O
(4)离子晶体;氯化钠;二氧化碳;氨
解析
(1)HF、H2O属于极性分子,CO2属于非极性分子;HF属于弱酸,Al(OH)3属于两性氢氧化物。
(2)O、F两种元素在周期表中位置相邻,由于二者均无最高价氧化物对应的水化物,且二者属于非金属,单质不与酸反应,故比较非金属性强弱的依据为a、c。
(3)Na与Al处于同一周期,由于Al(OH)3属于两性氢氧化物,因而它能与强碱氢氧化钠反应。
(4)碳酸钠属于离子晶体,工业常利用侯氏制碱法制备:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑故常用原料为NaCl、NH3、CO2。
知识点
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 ·
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为_ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_ (填化学式)。
③NaH2PO2为_ (填“正盐”或“酸式盐”)}其溶液显 (填“弱酸性”.“中性”或“弱碱性”)。
(3)H3PO2的工业制法是,将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式
(4)也可用电渗析法制备,“四室电渗析法”工作原理如图所示〔阳膜和阴膜分别只允许阳离子,阴离子通过):
①写出阳极的电极反应式 。
②分析产品室可得到H3PO2原因_ ·
③早期采用“三室电渗析法”制备H3PO2:
将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有_ 杂质.该杂质产生的原因是
正确答案
(1)H3PO2
(2) ①+1
②
③正盐 弱碱性
(3)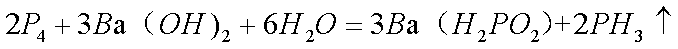
(4)①
②阳极室的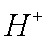
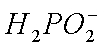

③
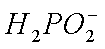
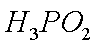
解析
略
知识点
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)
则平衡时氨气的转化率为________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=________。
正确答案
(1)NO2(g)+SO2(g)
(2)40%
(3) 1.12L;N2H4+H2O
(4) Kb(NH3·H2O)=1×10-5mol/L
解析
略。
知识点
扫码查看完整答案与解析