- 离子方程式的书写
- 共269题
MnO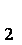
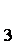

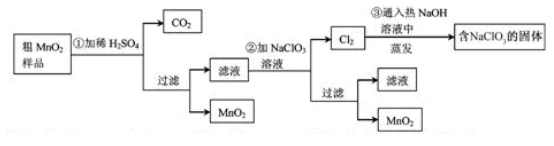
(1)第①步加稀H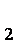
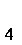
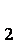
(2)第②步反应的离子方程式是__ _______+__ClO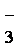
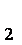

(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、_______、_______、_______,已知蒸发得到的固体中有NaClO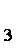
(4)若粗MnO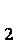
正确答案
(1)MnO2和MnCO3
(2)5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
(3)蒸发皿、酒精灯、玻璃棒;NaCl
(4)0.02
解析
本题综合考查离子反应方程式书写、氧化还原反应配平、化学计算以及化学实验的相关知识。情景简单,工艺流程清晰。
知识点
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为__________;
(2)估算该反应的平衡常数__________(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向__________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将__________(填“增大”、“减小”或“不变”),平衡将向__________移动。
正确答案
(1)
(2)
C起 0.09 0 0 0
C变 0.09×
C平 0.06 0.03 0.03 0.03

(3)正反应方向;
(4)增大,正反应方向
解析
略。
知识点
下列反应中,可用离子方程式H++OH-=H2O表示的是
正确答案
解析
略
知识点
下列离子方程式错误的是( )
正确答案
解析
略
知识点
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式________,属于弱酸的电离方程式________。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是________(选填编号)。
a. 气态氢化物的稳定性
b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易
d. 单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为________。
(4) Na2CO3俗称纯碱,属于________晶体。工业上制取纯碱的原料是________。
正确答案
(1)

(2)ac
(3)Al(OH)3+OH-=AlO2- +2H2O
(4)离子晶体;氯化钠;二氧化碳;氨
解析
(1)HF、H2O属于极性分子,CO2属于非极性分子;HF属于弱酸,Al(OH)3属于两性氢氧化物。
(2)O、F两种元素在周期表中位置相邻,由于二者均无最高价氧化物对应的水化物,且二者属于非金属,单质不与酸反应,故比较非金属性强弱的依据为a、c。
(3)Na与Al处于同一周期,由于Al(OH)3属于两性氢氧化物,因而它能与强碱氢氧化钠反应。
(4)碳酸钠属于离子晶体,工业常利用侯氏制碱法制备:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑故常用原料为NaCl、NH3、CO2。
知识点
扫码查看完整答案与解析