- 离子方程式的书写
- 共269题
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
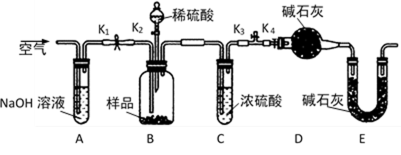
两同学利用下图所示装置进行测定
(2)在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
(3)装置E中碱石灰的作用是 。
(4)实验过程中有以下操作步骤:
a,关闭K1、K3,打开K2、K4,充分反应
b,打开K1、K4,关闭K2、K3,通入过量空气
c,打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) ;
若未进行步骤 ,将使测量结果偏低。
(5)若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuCO3的质量分数为 。
(6)丙同学认为还可以通过测量 来测定沉淀中CuCO3的质量分数。
正确答案
(1),Cu2+ + 2HCO3- →CuCO3↓+ CO2↑+ H2O
(或:Cu2+ + HCO3- →CuCO3↓+ H+ 、H+ + HCO3- → CO2↑+ H2O)
(2)过滤
(3)防止空气中CO2和水蒸气进入装置D
(4)cab ; b
(5) 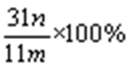
(6)CO2的体积(其它合理也给分)
解析
略
知识点
29.过碳酸钠(2Na2CO3·3H2O2)是一种多用途的新型消毒剂,可有效杀灭“甲型 H1N1流感”病毒。已知过碳酸钠是一种可溶于水的白色细小颗粒状粉末,50℃可分解,其3%的水溶液的pH约为10.5,过碳酸钠具有Na2C03和H202的双重性质。
(1)为探究过碳酸钠的性质,某同学用试管取适量过碳酸钠溶液,滴加酚酞试液。开始可能观察到的现象是_________,产生此现象的原因是_________(用离子方程式表示),微热并振荡试管后又可能观察到__________现象。
(2)已知过碳酸钠遇稀硫酸可产生两种气体。某化学课外活动小组利用以下装置完成了系列实验。
请回答下列问题:
①甲同学用装置I验证产生的两种气体,B中盛有足量的Ba(OH)2溶液,若观察到的现象是_________,则证明有________气体生成;简述验证另一种气体的方法 __________;
②乙侧学把上述装置组合,用于测定2Na2CO3·3H2O样品中Na2CO3的含量。按气流从左到右的方向,装置I、II、III的连接顺序是 ________(填装置序号); B、E中应分别盛放 ______、______;装置III中通空气的目的是___________- 。
正确答案
(1)溶液变红(1分)CO2-3+H2O
(2)①产生白色沉淀(1分)CO2(1分)取带有火星的木条靠近B瓶的导管出口,若木条复燃说明有氧气生成(2分)①III→I→II(2分)浓H2SO4(1分)NaOH溶液(1分)防止空气中的二氧化碳、水蒸气等气体进入C中(1分)将装置I中的二氧化碳全部排入C中(2分)等中的任意一种
解析
解析已在路上飞奔,马上就到!
知识点
26.银镜实验后,附着在试管壁上的银通常用硝酸溶解后回收银,但会产生有毒气体污染环境,爱动脑筋的小明想寻找一种绿色洗涤剂,既能洗涤试管回收银,又不会污染环境。
小明查阅资料获悉:双氧水接触银能发生剧烈反应。这一信息引起小明深思:它能不能用来洗涤试管壁上的银呢?
探究实验l:
取10mL,l0%的双氧水,倒入附有银的试管中,反应剧烈,有大量气泡产生,试管壁上的银全部被洗干净,试管中留下澄清、透明的液体X。
探究实验2:
洗涤过程的化学原理是什么?液体中银是以什么形式存在呢?
小明继续查阅资料获悉:AgOH不稳定。
取2支编号为试管l和试管2的干净试管,分别装入1mL液体X,并稀释至3mL。
试管l进行如下实验:
试管2加适量稀硝酸酸化,再滴加适量1mol/L氯化钠溶液出现白色沉淀。
根据以上探究回答下列问题:
(1)(2分)液体X可能属于哪一类分散系:( );
用什么方法可确证你的结论: ( ) ;
(2)(4分)操作Y的名称是: ( ) ;
画出把上层紫红色液体分离出来所用仪器的图形:
(3)(2分)在试管l中加入KI溶液,没有观察到黄色AgI生成,不可能的原因是:(填序号)
( );
①液体X中银元素是以单质形式存在;
②过量H2O2将KI中的I—氧化成I2;
③液体X中几乎不存在自由移动的Ag+;
④加入KI量太少。
(4)(2分)如果银与H2O2反应的生成物对H2O2分解有催化作用,通过分析,推测起催化作用物质是:(写名称) ( ) 。
(5)(2分)试管2中加入适量的HNO3酸化,其原因是:(用离子方程式表示) ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出.试回答:
(1)现需要80mL 0.02mol/L 标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯,玻璃棒和 __________;配制时, KMnO4溶液应用强酸酸化,本实验选择_________作酸化剂.若选择HNO3酸化,则结果可能 ___________(偏大,偏小,不变)
(2)草酸跟KMnO4反应的离子方程式为:__________________________。
(3)滴定时,根据现象____________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
经过计算,血液样品中Ca2+离子的浓度为___________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂. 以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色) 终点时:2Ag++CrO42-=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更______________的缘故。
正确答案
(1)100mL容量瓶、胶头滴管;稀H2SO4;偏小;
(2) 5 H2C2O4 + 2MnO4- + 6H+ = 1OCO2 + 2Mn2+ + 8H2O
(3)溶液由无色变为紫红色 (4)1.2 (5)小
解析
解析已在路上飞奔,马上就到!
知识点
24.工业上可以从冶炼锌、锌制品加工企业回收的废渣(含有

有关氢氧化物开始沉淀和沉淀完全的pH见下表
(1)向酸浸液中加入的试剂A有多种选择,若A是H2O2,反应的离子方程式是( );
(2)若试剂A为KOH稀溶液,当滴加至Cu2+恰好完全沉淀时,则滤液甲中:
(3)当酸浸液的pH用____(填试剂的化学式)调节到3.7至5.2时,可以使两种离子完全沉淀,写出其中任意一种沉淀反应的离子方程式( );
(4)检验沉淀丙是否洗涤干净,操作方法是( ),
在实验室进行焙烧时,盛放沉淀丙的仪器名称是( ).
(5)上述流程中所得Zn0产品中锌的含量远超过锌渣中锌元素的的含量,其原因是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析