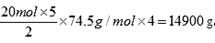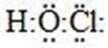- 离子方程式的书写
- 共269题
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
31.铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
32.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示0。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
33.纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。
正确答案
Cr2O72-+6e-+14H+=2Cr3++7H2O;
解析
Cr2O72-+6e-+14H+=2Cr3++7H2O;
考查方向
解题思路
正极上Cr2O72-转化为Cr3+,发生还原反应,结合电荷守恒书写电极方程式;
易错点
漏写H+,未配平等。
正确答案
①活性炭对Cu2+和Pb2+有吸附作用
②铁的质量分数增加,铁炭混合物中微电池数目减少;
解析
①活性炭对Cu2+和Pb2+有吸附作用
②铁的质量分数增加,铁炭混合物中微电池数目减少;
考查方向
解题思路
①当铁炭混合物中铁的质量分数为0时,则只有碳粉,碳粉具有吸附性,可去除水中少量的Cu2+和Pb2+;
②随着铁的质量分数的增加,形成的微电池数目减少,则Cu2+和Pb2+的去除率不升反降;
易错点
①不知道活性炭有吸附性。②不能想到铁炭混合物中形成微电池。
正确答案
(3)①碱性条件下,Fe2+被BH4-还原的离子方程式为:2Fe2++BH4-+4OH-=2Fe+ B(OH)4-+2H2↑;②若溶液的pH偏低,酸性太强,纳米铁粉与H+反应生成H2,导致NO3-的去除率下降;③Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。
解析
①2Fe2++BH4-+4OH-=2Fe+ B(OH)4-+2H2↑;②纳米铁粉与H+反应生成H2;
③Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。
考查方向
解题思路
①向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,结合质量守恒、电荷守恒可写出离子方程式;②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气;
③由图2可知铜离子浓度越大,去除率越大,铜离子可起到催化作用,也可能形成原电池反应.
易错点
书写离子方程式时没注意到NaBH4溶液的碱性。
【选做题】本题包括A、B两小题,请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
(A)[物质结构与性质] 【请回答第34、35、36、37、38小题】
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(B)[实验化学] 【请回答第39、40、41、42小题】
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
34.Zn2+基态核外电子排布式为____________________。
35.1 mol HCHO分子中含有σ键的数目为____________mol。
36.HOCH2CN分子中碳原子轨道的杂化类型是______________。
37.与H2O分子互为等电子体的阴离子为________________。
38.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
39.SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
40.装置Y的作用是______________________________。
41.析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
42.实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
正确答案
1s22s22p62s23p63d10(或[Ar] 3d10)
解析
锌是30号元素Zn2+核外有28个电子,基态核外电子排布式为1s22s22p62s23p63d10(或[Ar] 3d10)。
考查方向
解题思路
锌的原子序数是30,基态核外电子排布式为1s22s22p62s23p63d104s2;Zn2+核外有28个电子,为1s22s22p62s23p63d10。
易错点
把Zn2+当成Zn。
正确答案
3;
解析
甲醛分子中,含有两个碳氢单键和一个碳氧双键,含有的含有σ键的数目为3
考查方向
解题思路
单键都是σ键,双键是σ键加π键。
易错点
不知道如何判断σ键。
正确答案
sp3和sp;
解析
由HOCH2CN分子结构可知,有单键和三键,两个碳原子分别是sp3和sp杂化
考查方向
解题思路
杂化类型的判断可以根据分子结构式进行推断,杂化轨道数=中心原子孤电子对数(未参与成键)+中心原子形成的σ键个数,方法二为根据分子的空间构型推断杂化方式,①只要分子构型为直线形的,中心原子均为sp杂化,同理,只要中心原子是sp杂化的,分子构型均为直线形。②只要分子构型为平面三角形的,中心原子均为sp2杂化。③只要分子中的原子不在同一平面内的,中心原子均是sp3杂化。④V形分子的判断需要借助孤电子对数,孤电子对数是1的中心原子是sp2杂化,孤电子对数是2的中心原子是sp3杂化。
易错点
两个碳原子的杂化类型不同。
正确答案
NH2-;
解析
水是三原子10电子分子,其等电子体的阴离子为NH2-
考查方向
解题思路
等电子体的概念是指具有相同电子数和原子数的微粒。
易错点
等电子体的概念不清。
正确答案
解析
由于[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,故其结构为:
考查方向
解题思路
该题的另一个难点是配位键的表示,注意掌握配位键的含义,理解配体、中心原子等。
易错点
未掌握配位键的含义。
正确答案
2SO2+CO32-+H2O=2HSO3-+CO2
解析
依题意,SO2与Na2CO3溶液反应生成了NaHSO3和CO2,即:2SO2+CO32-+H2O=2HSO3-+CO2
考查方向
解题思路
亚硫酸的酸性大于碳酸。
易错点
把离子方程式写成化学方程式。
正确答案
防止倒吸
解析
Z是为防止污染空气的吸收SO2 装置,为防止Z中液体倒吸进X中,应加Y装置。
考查方向
解题思路
装置Y是安全瓶。
易错点
化学实验基本操作中防倒吸的常见装置不清楚。
正确答案
①抽滤瓶;②减少Na2S2O5的在水中的溶解;
解析
①过滤时用的是布氏漏斗和抽气泵,所以,一定要用到抽滤瓶;②为了减少Na2S2O5的在水中的溶解;需用饱和SO2水溶液洗涤。
考查方向
解题思路
减压抽滤装置的主要仪器有布氏漏斗、抽滤瓶和抽气泵。
易错点
为掌握抽滤操作。
正确答案
在制备过程中Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4。
解析
在制备过程中因Na2S2O5可能分解生成生Na2SO3,而Na2SO3由部分被氧化生成Na2SO4,故,制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4。
考查方向
解题思路
明确物质的性质和实验原理是解答的关键。Na2S2O5固体中含有一定量的Na2SO3因Na2S2O5分解生成的。
易错点
认识不到的Na2S2O5不稳定性。
NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
23.第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
24.写出第二次氧化时发生反应的离子方程式。
_______________________________________
25.处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
26.(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
27.上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
28.HCN是直线型分子,HCN是___________分子(选填“极性”或“非极性”)。HClO的电子式为___________。
正确答案
碱性;防止生成HCN,造成人员中毒或污染空气。
解析
依据HCN的电离平衡常数可知HCN是极弱的酸,所以NaCN极易于酸反应生成HCN。为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性。
考查方向
解题思路
对于HA
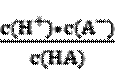
易错点
不能根据Ki值大小判断酸性的强弱。
正确答案
2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑
解析
NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2,首先确定反应物和生成物;再依据反应中氯元素的化合价从+1价降低到-1价,得到2个电子。N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑。
考查方向
解题思路
先确定反应物和生成物,再找化合价的变化,最后通过守恒法求氧化剂和还原剂之间的比例关系。
易错点
不会根据电子得失守恒可知还原剂和氧化剂的物质的量之比。
正确答案
14900
解析
NaCN被氧化的两个阶段氧化剂均为NaClO,所以可以合并一起进行计算,即反应物为NaCN和NaClO,生成物为:Na2CO3、CO2、NaCl和N2。参加反应的NaCN是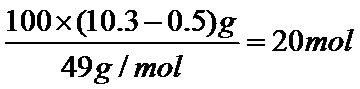
考查方向
解题思路
在氧化还原反应中遵循电子守恒,即氧化剂得到的电子的物质的量(或个数)等于还原剂失去的电子的物质的量(或个数)。
易错点
不能运用电子守恒法解题。
正确答案
NaOC
解析
类比Cl2和 NaOH溶液反应生成NaCl+NaClO,所以,该反应的产物为:NaCN、NaOCN(NaCNO)
考查方向
解题思路
(CN)2与NaOH溶液反应可以采用类推法的思想,类比Cl2和 NaOH溶液反应生成NaCl+NaClO。
易错点
Cl2和 NaOH溶液反应不会写化学方程式。
正确答案
3p;H
解析
由Cl的核外电子排布情况,核外电子能量最高的电子亚层是3p亚层;依据元素周期律不难排出相关元素的原子半径大小为:H
考查方向
解题思路
氯原子核外电子排布1s2 2s2 2p6 3s2 3p5,能量最高的电子亚层是3p。同周期从左向右原子半径在逐渐减小;同主族从上到下原子半径在逐渐增大。
易错点
原子半径的递变规律未掌握。
正确答案
极性;
解析
HCN分子是直线型,肯定正负电荷重心不重合,故为极性分子;从HClO的各元素化合价判断,其电子式为:
考查方向
解题思路
在HClO分子中H、Cl只能形成单键,O要形成双键。所以其电子式中O写在H、Cl之间。
易错点
HClO的电子式误写为Cl在H、O之间。
4.下列表述和方程式书写都正确的是
正确答案
解析
A. 水为液态时稳定,则乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l) =﹣1367.0kJ•mol﹣1,故A错误
B. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,说明硫酸根和钡离子的物质的量之比是1:2,离子方程式为:A
C. 浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故C错误
D.硫酸酸化的橙色的重铬酸钾溶液具有强氧化性,能够氧化乙醇,同时生成乙酸和草绿色的三价铬,可以用于检测是否酒后驾驶,反应的离子方程式为::2Cr2O72﹣+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O,故D正确
故本题选择D
考查方向
解题思路
A. 燃烧热的热化学方程式中,水的状态必须为液态
B. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀,说明硫酸根和钡离子的物质的量之比是1:2
C.浓盐酸可以被酸性高锰酸钾溶液氧化
D. 重铬酸钾在酸性条件下具有强氧化性,能够氧化乙醇,溶液由橙色变为绿色
易错点
配平错误、电荷不守恒
知识点
扫码查看完整答案与解析