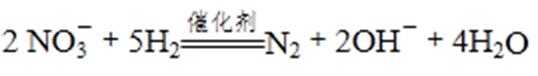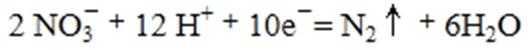- 用盖斯定律进行有关反应热的计算
- 共44题
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)===2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)===CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G 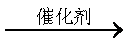
下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3
b.CO2
c.SO2
d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为: 。
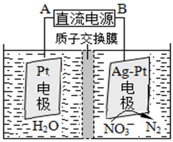
②在酸性条件下,电化学降解NO的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。
正确答案
见解析。
解析
(1)
(2) -574.1
(3)还原剂,ad
(4)①
②A
知识点
13.将下图所示实验装置的K闭合,下列判断不正确的是( )

正确答案
解析
略
知识点
化学工艺:电化学是研究两类导体形成的带电界面现象及其上所发生的变化的科学。电化学在化工、冶金、机械、电子、航空、航天、轻工、仪表、医学、材料、能源、金属腐蚀与防护、环境科学等科技领域获得了广泛的应用。下面是在实验室进行电化学实验的相关内容。
已知丙中溶质不止一种,请填写上表并完成下列问题。
29. 甲烧杯中铁电极浸在稀硫酸中却不被氧化,此处所用的金属保护方法是 (具体到类型),以下与上述方法相同的是 ,以下不属于电化学防护方法的是 。
a. 远洋轮船表面镶嵌锌块
b. 在铁表面镀锡制成“马口铁”
c. 大坝船闸钢与电源负极相连
d. 在钢铁中加入铬熔制成不锈钢
30. 若使a、b两电极直接相连,将发生 (选填“析氢”或“吸氧”)腐蚀,实验现象
是 ,设计最简易实验检验该反应所生成的两种产物。
。
31. 丙烧杯中的溶质是 ,若在导线中通过0.06mol电子时,恰好开始产生气体,生成的红色固体为1.28g,则两溶质的初始物质的量之比为 ,此时溶液中的溶质成分为
。并在图中用箭头标出装置中电子的流动方向。
生产前线:“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 →NH2Cl + HCl,生成的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。
32. ① 氯胺能用于消毒杀菌的原因是 (用化学方程式表示)。
② 经氯胺消毒法处理后的水中,氮元素多以NH4+ 的形式存在。
已知:NH4+(aq)+1.5O2(g)→NO2-(aq)+2H+(aq)+H2O(l)+273 kJ
NH4+(aq)+2O2(g)→NO3-(aq)+2H+(aq)+H2O(l)+346 kJ
则NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
33. 用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是 。
a. 
b.
c. c(H+)·c(OH-)
d.
34. 铝铵矾[NH4Al(SO4)2•12H2O]也是常用的工业净水剂,其净水的化学原理是 (用离子方程式表示)。在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确是 。
a. n(SO42-)>n(NH4+)>n(Al3+)>n(OH-)
b. n(Al3+)>n(NH4+)>n(SO42-)>n(H+)
c. n(BaSO4)>n[Al(OH)3]>n(NH3·H2O)>n(AlO2-)
d. n(NH3·H2O)>n(BaSO4)>n[Al(OH)3]>n(AlO2-)
另一常用净水剂高铁酸钾(K2FeO4)在净水过程中除了与铝铵矾相似的化学原理和作用之外,它的另一作用是 ,这体现了它的 (填写性质)。
正确答案
见解析。
解析
29. 外加(接)电流(电源负极)的阴极保护法;c;bd(提示:b化学保护法,d是改变内部结构,非电化学法)
30. 析氢;铁片溶解,石墨上有气泡;爆鸣实验:收集一试管正极气体(H2),用拇指捂住试管口慢慢移动至酒精灯上方,松开拇指后听到“噗”声则说明是纯净的氢气(写还原氧化铜等,不符合“简易”,不给分);取负极附近溶液于试管,先滴加硫氰化钾溶液,溶液不变色,再滴加氯水,溶液变为血红色,则说明生成Fe2+离子(要取样,要排除三价铁,所以顺序不能颠倒)
31. 硫酸铁、硫酸铜[Fe2(SO4)3、CuSO4];1:2(对应);硫酸亚铁、硫酸(FeSO4、H2SO4)三个箭头
32. NH2Cl+H2O→NH3+HClO;2NO2-(aq)+O2(g)→2NO3-(aq)+146 kJ
33. d
34. Al3++3H2O
知识点
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+


C(s)+ O2(g)==CO2(g) 

S(s)+O2(g)==SO2(g) 

则SO2(g)+2CO(g)==S(s)+2CO2(g) 
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
700oC时,其中最难被还原的金属氧化物是________(填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于________。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为________。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。
正确答案
(1)C
(2)-(2Q2-2Q1-Q3) kJ·mol-1或(2Q1-2Q2+Q3)kJ·mol-1
(3)Cr2O3;10-12
(4)NO2+NO3--e-=N2O5;224
解析
略。
知识点
关于下图所示转化关系(X代表卤素),说法不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析