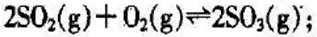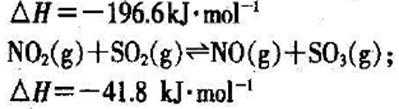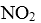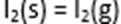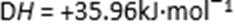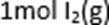- 用盖斯定律进行有关反应热的计算
- 共44题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成___________而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = _____ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 ________________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ________________。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:

水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
下列叙述正确的是 ________________(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
正确答案
见解析。
解析
(1)铜或Cu
(2)-(a+b-2c)kJ/mol或2c –a-b
(3)2Cu-2e-+2OH-=Cu2O+H2O。
(4)4Cu(OH)2 + N2H4
(5)C
知识点
28.碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)

A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+O2(g)==CO(g) H= -Q1 kJ·mol-1
C(s)+ O2(g)==CO2(g) H= -Q2 kJ·mol-1
S(s)+O2(g)==SO2(g) H= -Q3 KJ·mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g) H= kJ·mol-1 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
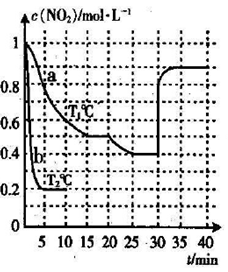
27.在2L的密闭容器内投入一定量NO2,发生反应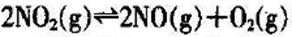
(1)已知:
(2)下列描述中,一定能说明密闭容器中的反应达到平衡状态的是( )(填字母代号)。
A.v(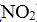
B.混合气体的颜色保持不变
C.密闭容器中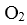
D.密闭容器中NO和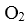
(3)实验a中,从反应开始至第一次刚达到平衡时段,生成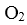
(4)由图像信息推断,T1℃( )T2℃(填“低于”或“高于”),理由是( )。
(5)20-25 min时间段,a曲线变化的可能原因是( )(填字母代号,下同),30-35min时间段.a曲线变化的可能原因是( )。
A.升高温度 B.缩小容器体积 C.降低温度 D.扩大容器体积
E.在恒容条件下充入
(6)若在实验b初始,向该2L密闭容器中通入的是1mol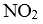
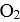
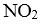
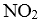
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.碘与氢气反应的热化学方程式是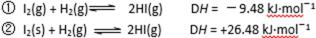
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.用CH4催化还原NOx可以消除氮氧化物的污染。
若在用CH4还原9.2gNO2气体至N2,则下列说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析