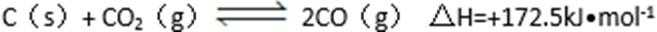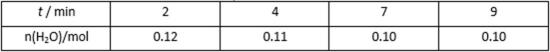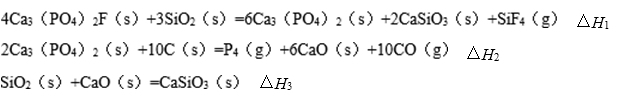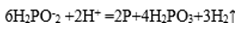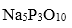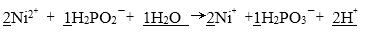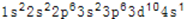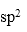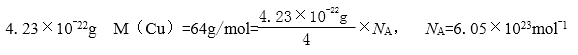- 用盖斯定律进行有关反应热的计算
- 共44题
27. “低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
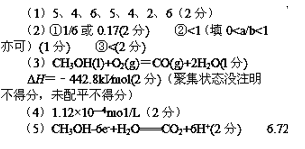
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:___C+___KMnO4+____H2SO4→____CO2+____MnSO4+____K2SO4+____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
①实验2条件下平衡常数K=_____。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 _____V逆(选填“<”,“>”或“=”)。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
③H2O(g)=H2O(l)_____ΔH=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____ 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 _____mo1/L。
(5)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式 _____。当电子转移的物质的量为0.6mol时,参加反应的氧气的体积是_____L(标准状况下)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. 



(1)250℃时,以镍合金为催化剂,向4 L容器中通入

①此温度下该反应的平衡常数K=__________
②已知:
反应
(2)以二氧化钛表面覆盖


①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是( )
②为了提高该反应中
③将
(3)

a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
②










(4)利用反应A可将释放的


正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. 碳及其化合物有广泛的用途。
(1)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,
则
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为( ) 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= ( )(小数点保留3位);若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将( )移动(填“向左”、 “向右”或“不”); 20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是( )(填序号);
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)利用







(4)肼(
(5)


正确答案
解析
知识点
请从36~38题中任选一题作答
36.【化学——选修2:化学与技术】第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
已知相同条件下:
用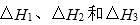
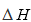
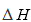
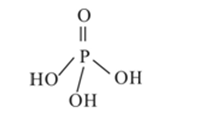
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为( ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为( );
(3)次磷酸钠( 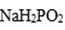
①化学镀镍的溶液中含有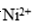
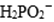
(a)_____ 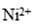
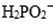
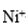
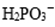
(b)
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。方法上的不同点:( );原理上的不同点:( );化学镀的优点:( )。
37.【化学—选修3:物质结构与性质】
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)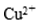
(2)Mn基态原子核外处在能量最高的能级上的电子共有( )种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成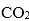
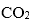
① 
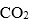

② HCHO分子中C原子轨道的杂化类型为( );
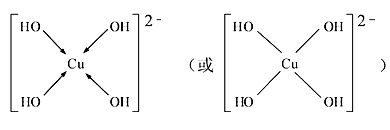
(3)向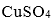
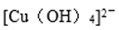
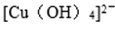
(4) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示: 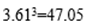
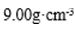
38.【化学—--选修5:有机化学基础】
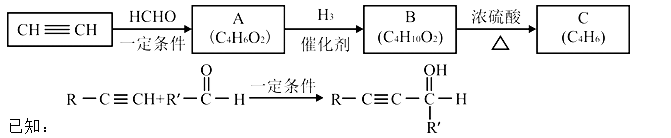
以乙炔或苯为原料可合成有机酸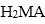
I.用乙炔等合成烃C。
(1)A分子中的官能团名称是( )、( )。
(2)A的一种同分异构体属于乙酸酯,其结构简式是( )
(3)B转化为C的化学方程式是( ),其反应类型是( )。
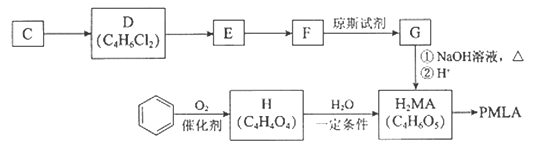
II.用烃C或苯合成PMLA的路线如下。
已知:
(4)1 mol有机物H与足量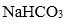
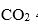
(5)E的结构简式是( )
(6)G与NaOH溶液在加热条件下反应的化学方程式是( )
(7)聚酯PMLA有多种结构,写出由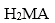
正确答案
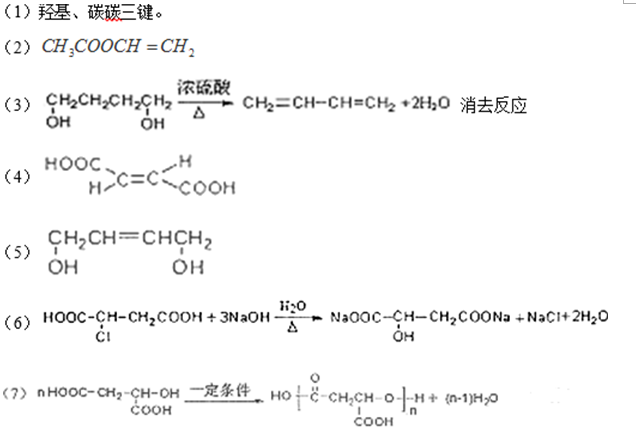
36.(1)
(2)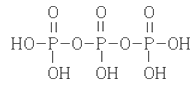
(3)
(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应;装置简便,节约能源,操作简便
37.(1)
(2)5
(3)①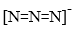
(4)
(5)
38.
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析