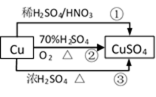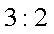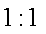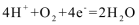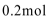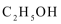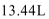- 化学反应原理
- 共2396题
hey
正确答案
10.关于下列各装置图的叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10. 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。右图为RFC工作原理示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
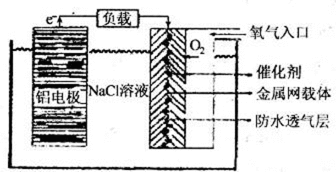
27.铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是( )。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如
图所示。
①该电池的总反应化学方程式为( );
②电池中NaCl的作用是( )。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为( )。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为( )。
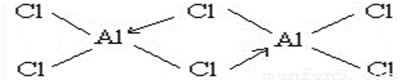
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为( )。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式( )。
正确答案
(1)第三周期第ⅢA族
(2)
①4Al+3O2+6H2O=4Al(OH)3
②增强溶液的导电能力
③I-+3H2O-6e-=IO3-+6H+
④2.7g
(3)
①
②Al2O3+3C+3Cl2
解析
解析已在路上飞奔,马上就到!
知识点
28.二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol 
D.该体系中

②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件( )(填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:( )。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
正确答案
(1)
①AB
②0.20 C
(2)
①CH3OH-6e-+H2O=CO2+6H+
②2Cl-+2H2O 
(3)CH3OH(l) +

解析
解析已在路上飞奔,马上就到!
知识点
CuSO4是一种重要的化工原料,其有关制备途径如右图所示。下列说法不正确的是( )(已知:2Cu
正确答案
解析
略
知识点
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程
① 3Fe



② Na2FeO2



③ Na2FeO2



(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是
A,该生产过程不会产生污染
B,反应③生成的四氧化三铁具有抗腐蚀作用
C,反应①②③均是氧化还原反应
D,反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 
正确答案
(1) 6,1,5,3,1,7
(2)Fe 
(3)BD
(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动
解析
略
知识点
11. 由于具有超低耗电量、寿命长的特点,LED产品越来越受人们欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.2010年1月12日下午,海地发生7.0级强烈地震,首都太子港通讯全部中断,中国第一支救援部队到达海地后,采用遥感通讯设备与外界联系。该设备使用一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为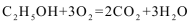
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
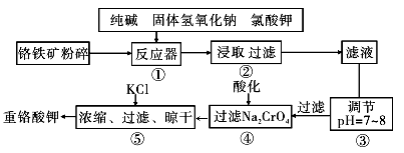
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铬铁矿粉碎的目的是________。
(2)步骤③调节pH后过滤得到的滤渣是________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于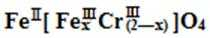
A. x =0.5 ,a =8
B. x =0.5 ,a = 10
C. x = 1.5 ,a =8
D. x = 1.5 ,a = 10
正确答案
(1)增大接触面积,增大反应速率。
(2)Al(OH)3;H2SiO3
(3)2CrO42-+2H+ 
(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。
(5)D
解析
略。
知识点
用A.b两个惰性电极电解0.2L一定浓度的硫酸铜溶液,当a极上产生4.48L(标况)气体时,b极上只有固体析出。然后将电源反接,当b极产生4.48L(标况)气体时,溶液质量共减少45.4克。下列说法正确的是( )
正确答案
解析
略
知识点
某体系中存在如下反应:
① H2S+4H2O-8e → SO42-+10H+ ② 2IO3-+12 H++10e → I2+6H2O
(1)反应①中H2S做__________剂,反应②属于___________ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成 g 碘。
(3) 写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________。
(4)由上述反应可推知 。
a.氧化性:K2SO4 > KIO3 b.酸性:HIO3 > H2SO4
c.还原性: H2S > I2 d.反应过程中溶液的酸性逐渐减弱
正确答案
(1)还原,还原。
(2) 5.08 g 碘。
(3)
(4) c
解析
略
知识点
双氧水可作为采矿业废液的处理剂,如用来消除采矿废液中的氰化物,反应方程式如下:
KCN


正确答案
解析
略
知识点
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu (NO3)2。在所得溶液中加入l.0 mol/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法错误的是
正确答案
解析
略
知识点
扫码查看完整答案与解析