- 化学反应原理
- 共2396题
1.下列物质在生活中应用时,起还原作用的是( )
正确答案
知识点
8. 以下事实不能用元素周期律解释的是
正确答案
解析
同主族的非金属,从上到下,非金属性逐渐减弱,F和I是同主族,非金属性越强,其化学性质更活泼,所以A的说法正确,但不是题目要求的答案,所以A不可选;同理,O和S是同主族,O的非金属性比S的非金属性强,O所形成的氢化物比S形成的氢化物更稳定,所以B也不可选;同周期的非金属,从左到右,非金属性逐渐增强,Cl和Si是同周期,Cl的非金属性更强,易得电子,与金属钠更易形成离子键,而Si不容易失电子,与Cl易形成共价键,所以C也不可选;NO2球”在冷水中颜色变浅,在热水中颜色加深,是由于发生了可逆反应:2NO2≒N2O4,条件改变,必定引起平衡移动,所以此题选D
考查方向
元素周期律及其应用的考查
解题思路
同主族的非金属,从上到下,非金属性逐渐减弱;同周期的非金属,从做到右,非金属性逐渐增强;
易错点
元素周期律和化学平衡移动混用,概念区分度不够
教师点评
元素周期律是种规律,不会跟外界条件的改变而改变
知识点
铜冶金技术以火法冶炼为主。
27.火法炼铜的工艺流程如下:
28.炼铜的副产品SO2多用于制硫酸和石膏等化学产品。
① 制硫酸中重要的一步反应是 2SO2(g)+O2(g)
② 下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO 2发生反应的原因________。
29.工业硫酸中往往含有一定量SO 2 ,测定过程如下:取m g工业硫酸配成100 mL溶液,取出20.00 mL溶液,加入1 mL指示剂,用c mol·L-1 I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是________。
正确答案
(1)① 6 ②-217.4 ③2︰1
解析
(1)① 可知S由-2变为+4,转移6 电子
②盖斯定律的计算(I+ II)/3= -217.4
③根据反应I、 II可知所需Cu2S 质量为2︰1
考查方向
解题思路
化学反应的能量变化与过程无关,可以用盖斯定律计算,用平衡移动原理解释说明沉淀的转化,迁移中和滴定的知识进行氧化还原定量计算
易错点
盖斯定律计算和用平衡移动解释说明问题易错
正确答案
(2)① 压强 80 ② CaCO3悬浊液中存在CaCO3(s)
解析
(2)①随横坐标增大而增大,所以是压强, K=1.62/(0.4*0.2)=80 ② CaCO3悬浊液中存在CaCO3(s)
考查方向
解题思路
化学反应的能量变化与过程无关,可以用盖斯定律计算,用平衡移动原理解释说明沉淀的转化,迁移中和滴定的知识进行氧化还原定量计算
易错点
盖斯定律计算和用平衡移动解释说明问题易错
正确答案
(3)
解析
(3)
考查方向
解题思路
化学反应的能量变化与过程无关,可以用盖斯定律计算,用平衡移动原理解释说明沉淀的转化,迁移中和滴定的知识进行氧化还原定量计算
易错点
盖斯定律计算和用平衡移动解释说明问题易错
25.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20. 部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30.污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、__________;其中玻璃棒的作用是__________ 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是__________。(只用文字表述)
(3) 已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是__________mol/L。
(4) 工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式__________。
(5) 下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液
b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液
d. 氨水、酚酞试液
(6) 废气中SO2与稀硫酸酸化的软锰矿反应的化学方程式为__________; 已知废气中SO2浓度为6.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体(MnSO4•H2O,相对分子质量为169)质量为__________kg(结果保留3位有效数字)。
正确答案
(1) 漏斗;引流(防止液体溅出)。
(2)消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
(3)1.3×10-17mol/L
(4)
(5)b c
(6)MnO2+ SO2=MnSO4; m=15.2(kg)
解析
解析已在路上飞奔,马上就到!
知识点
29.Ⅰ.下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1 表2
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是( )(填序号)
A.升高温度
B.加水稀释
C.加少量的
D.加少量冰醋酸
(2)
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(

Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
在一定压强下,测得上述反应的实验数据如下表。
根据表中数据分析:
①上述反应的a( )0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即
或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和
①写出CO和H2制备乙醇的热化学反应方程式( )。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol 
(3)二甲醚(
正确答案
Ⅰ.
(1)B
(2)中性
(3)0.24
Ⅱ.
(1)
①小于
②不变
(2)
①2CO(g)+4H2(g) 
②4Q<w<2E2
(3)CH3OCH3-12e-+16OH- = 2CO+ 11H2O
解析
解析已在路上飞奔,马上就到!
知识点
25.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
i.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
ii.将SiCl4分离,得到纯净的TiCl4。
iii.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
iiii.TiO2·xH2O高温分解得到TiO2。
①分离TiCl4与SiCl4所采取的操作名称是( )。
② Ⅲ中反应的化学方程式是( )。
③ 如Ⅳ在实验室完成,应将TiO2·xH2O放在( )(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2


① b反应过程破坏的化学键是( ) 。
② H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的( )
(填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
① 如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g,则CO的转化率为( )。
② 当CO气体全部通入后,还要再通一会儿空气,其目的是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
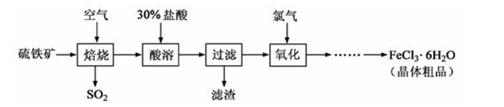
24.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)将煅烧黄铁矿的化学方程式补充完整: FeS2+ O2 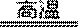
该反应中,FeS2为( )剂;SO2为( ),其常用于制备硫酸,反应过程中的化学反应方程式为( )、 SO3+H2O=H2SO4
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和 ( );
(3)通氯气氧化时,发生的主要反应的离子方程式为( );
(4)该过程产生的污染空气的气体有三种,尾气均可用强碱溶液吸收,其中氯气被吸收的离子方程式为( )。
(5)从FeCl3溶液中得到FeCl3.6H2O晶体的操作为 ( ) 。
正确答案
答案已在路上飞奔,马上就到!
解析
解析已在路上飞奔,马上就到!
知识点
33.Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ( );向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式:( )。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水,( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列关于有机物的叙述中有( )句话是正确的。
①福尔马林、酒精均可使蛋白质变性
②石油的炼制过程不都是化学变化
③麦芽糖、淀粉水解的最终产物均为葡萄糖
④甲烷分子的比例模型:
⑤天然气和石蜡的主要成分都是碳氢化合物
⑥用饱和氢氧化钠溶液除去乙酸乙酯中的少量乙酸
⑦煤的液化和气化是物理变化
⑧苯和乙烯两种物质均能使溴水和酸性高锰酸钾溶液褪色,且反应类型也相同
正确答案
解析
①福尔马林、苯酚、酒精均可使蛋白质发生变性;
②石油的分馏过程属于物理变化;
③麦芽糖、淀粉水解的最终产物均为葡萄糖;
④甲烷分子的比例模型:
⑤天然气和石蜡的主要成分都是烃;
⑥饱和碳酸钠溶液与乙酸反应,降低乙酸乙酯的溶解度;
⑦煤的液化是化学变化;
⑧酸性高锰酸钾溶液氧化乙烯气体生成二氧化碳。
考查方向
解题思路
①福尔马林、苯酚、酒精均可使蛋白质发生变性;
②石油的分馏过程属于物理变化;
③麦芽糖、淀粉属于糖类;
④甲烷分子的比例模型:
⑤天然气和石蜡的主要成分都是烃;
⑥饱和碳酸钠溶液降低乙酸乙酯的溶解度;
⑦煤的液化是化学变化;
⑧酸性高锰酸钾溶液氧化乙烯气体生成二氧化碳。
易错点
有机反应、有机物除杂、性质与用途。
知识点
7.《新修本草
正确答案
解析
“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末为红色,
A为蓝色晶体,
B为FeSO4•7H2O是绿色晶体,
C为KAl(SO4)2•12H2O是无色晶体,
D为Fe2(SO4)3•9H2O为黄色晶体,
所以判断“青矾”的主要成分为FeSO4•7H2O,故选B.
考查方向
铁的氧化物和氢氧化物
解题思路
“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末为红色。
易错点
本题容易混淆亚铁盐和铁盐转化的颜色变化,容易理解错题给信息。
知识点
6.在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g) 2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是()
正确答案
解析
A.t2时逆反应速率增大,说明是使用了催化剂,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以化学平衡常数:KI=KII;
B.由于II过程达到平衡后,化学平衡逆向移动,当达到平衡时逆反应速率小于开始时的正反应速率,所以平衡时其中NH3的体积分数:I<II;
C.由于容器的容积不变,反应混合物都是气体,所以在任何时刻气体的密度都不变;
D.若t2时刻改变的条件是向密闭容器中加H2和N2混合气,则反应的正反应速率应该突然增大,逆反应速率不变,这与图像不吻合。
考查方向
解题思路
A.化学平衡常数只与温度有关:KI=KII;
B.由于II过程达到平衡后,化学平衡逆向移动;
C.由于容器的容积不变,在任何时刻气体的密度都不变;
D.反应的正反应速率应该突然增大,逆反应速率不变。
易错点
容器的容积不变,在任何时刻气体的密度都不变。
知识点
6.常温下,下列有关稀溶液中离子浓度的说法正确的是
正确答案
解析
A:(NH4)2SO4电离出来的NH4+是最多的, NH4HSO4中H+的存在抑制了NH4+的水解,而
NH4Al(SO4)2中Al3+水解也会抑制NH4+的水解,NH4+与Al3+相互抑制水解,NH4CL没有抑制水解的
物质存在,也没有促进水解的物质存在,所以正确的排序应该为②>③>④>①
B:由NaHS化学式可知,Na元素与S元素为1:1关系,故有c(Na+)= c(H2S),水解:HS-+H2O⇌H2S+OH-
H2O⇌H++OH-,c(OH-)= c(H+)+ c(H2S),电荷守恒式:c(Na+)+ c(H+)= c(OH-)+ 2c(HS-),可推出c(Na+)+
c(OH-)= c(H+)+ 2c(H2S),对
C:NH4Cl溶液中,c(Cl-) 是最大的为:0.1 mol /L,而此溶液中离子浓度最小的是水电离生成的H+
和OH-为1×10-9,所以C错。
D: CH3COONa水解生成CH3COOH,CH3COOH会抑制水的电离,所以CH3COONa中由水电离出来的
H+浓度减小,而NH3· H2O是弱碱,弱碱电离出来的离子浓度不大,对水的电离的抑制不如CH3COONa
的强,③>④,故D错
考查方向
解题思路
溶液中离子水解和是否存在其它离子抑制其水解,找到化学反应中关键元素的对应守
恒关系;正确分析溶液中存在的离子,尤其注意水的电离,判断离子的浓度就比较简单了;根据离
子的水解方程式判断溶液中水电离的H+浓度就比较容易了;
易错点
不能正确分析各种离子水解过程和程度,不能正确判断化学反应守恒的标志元素,以及
溶液中的电荷守恒、质子守恒、物料守恒的的应用错误和概念的理解失误,盐类水解后离子浓度的
变化情况的判断失误
知识点
7. N2 (g) 与H2 (g) 在铁催化剂表面经历如下过程生成NH3 (g) :
下列说法正确的是
正确答案
解析
A、I 中破坏的是非极性键;
B、Ⅵ中是 NH2和H 生成 NH3;
C、三个过程均是能量降低,所以是放热过程;
D、由图可知反应物的能量高于生成物的能量,是放热反应,因此△H < 0。
考查方向
解题思路
判断出反应物和生成物,然后判断出化学键成断键能量的+、-,基于图形数据进行计算。
易错点
化学键成断键能量的+、-。
知识点
扫码查看完整答案与解析