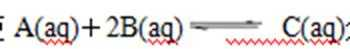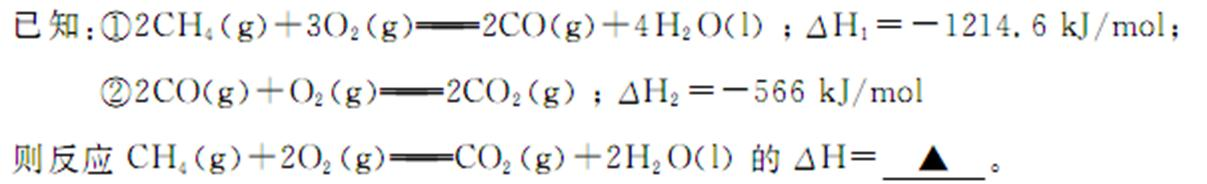- 化学反应原理
- 共2396题
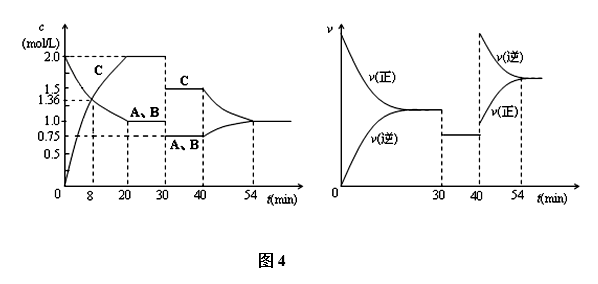
13.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是: 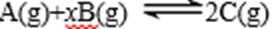
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某化学反应
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为 ( )。
(2)实验2中,A的初始浓度c2= ( )
(3)测得实验2和实验3各组分百分含量相等。设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 ( ) v1(填“>”“=”或“<”),且c3=( )
(4)实验4和实验1仅起始温度不同。比较实验4和实验1,可推测该反应的正反应是( )反应(填“吸热”或“放热”),理由是( )。
(5)实验4中,假定在50 min将容器的容积缩小为原来的一半,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(1)反应
分别在三种不同实验条件下进行,它们的起始浓度均为:c(A)=0.100 mol/L、
c(B)=0.200 mol/L 、 c(C)=0 mol/L。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
Ⅰ.与①比较,②和③分别仅改变一种反应条件。
所改变的条件是:②_____________________;
③_____________________。
Ⅱ.实验②平衡时B的转化率为______;
Ⅲ.该反应的ΔH________0;
Ⅳ.该反应进行到4.0min时实验②的平均反应速率:v(B)=_________________;
(2)在一定条件下,二氧化硫和氧气发生如下反应:
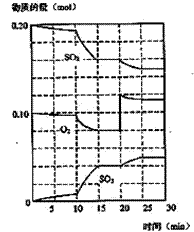

①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反
应过程中SO2、O2、SO3物质的量变化如图,反应处于
平衡状态的时间段 ( )。
②据图判断,反应进行至20min时,曲线发生变化的原因
是(用文字表达)( )
③10min到15min的曲线变化的原因可能是( )
(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)某温度下体积为200L的氨合成塔中,测得如下数据:
根据表中数据计算0~2小时内N2的平均反应速率为( )mol·L-1·h-1,若起始时与平衡时的压强之比为a,则N2的转化率为( )(用含a的代表式表示)
(2)希腊阿里斯多德大学的George Mamellos和Michael Stoukides,发明了一种合成氨的新方法(Science, 2, Oct, 1998, p98),在常压下,把氢气和用拟气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和用氦气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式为( )。
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图)

(4)合成塔中反应的原料利用率不是很高,所以在工业采取气体循环的流程。即从合成塔出来的气体通过降低温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法( )(填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
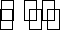
26.(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。
其负极电极反应式是:叁一。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:

①实验1中,以v( H2)表示的平均反应速率为:( )。
②该反应的正反应为( )(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是( )(用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2 SO4溶液。
①该电解槽中通过阴离子交换膜的离子数( )(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为( );
③电解一段时间后,B出口与C出口产生气体的质量比为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g)
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
② 该电池工作时,正极是 极(填“a”或“b”);
②该电池负极反应的离子方程式为 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有( )(填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)物质B的电子式为( );图1中反应①的化学方程式是( ) 。
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是( )(填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l mol甲和2 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,则用甲表示的化学反应速率为( ) 
(5)若对(4)中的1 mol甲和2 mol C的混和气体分别只改变一个实验条件(温度、压强、催化剂)后,得到D的物质的量随时间的变化曲线①和②(如图3所示),则曲线①、②所改变的具体实验条件分别是:① ( );② ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.密闭容器中X、Y、Z三种气体的初始浓度和不同温度下的平衡浓度如下表:下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
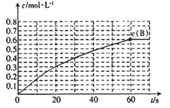
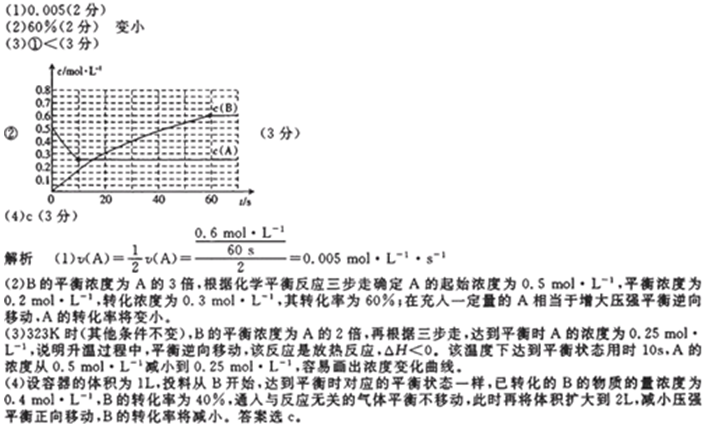
27. 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)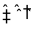
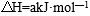
回答下列问题:
(1)前60s内A的平均反应速率为( )mol/(L·s)。
(2)若B的平衡浓度为A的3倍,则A的转化率为( ),在70s时再向容器中通入一定量的A气体,再次达到平衡时A的转化率将( )(选填“不变”或“变大”或“变小”)。
(3)其他条件不变,反应在323K进行,B的平衡浓度为A的2倍,且达到平衡所需时间为298K时的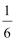
①该反应的△H ( ) 0(填“>”或“<”)
②请在图中画出323K时A的物质的量浓度随时间的变化曲线。
(4)若反应在298K进行,在2L密闭容器中加入1molB、0.2molNe,达到平衡B的转化率为( ) 。
a.等于60%
b.等于40%
c.小于40%
d.介于40%—60%之间
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某同学欲探究
请回答下列问题:
(1)用pH试纸测定溶液pH的操作方法是( );
(2)写出生成白色沉淀W所涉及的离子方程式( );
(3)写出
(4)取三支大小相同的试管,通过测定
①V=( );
②探究浓度对化学反应速率的影响,应选择( )(填实验编号)组实验进行对比分析;
③为了准确控制反应的温度,应采用的加热方式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.在容积为2L,且体积保持不变的密闭容器内加入0.4molN2和1.2molH2,在一定条件下发生如下反应:N2(g)+3H2(g)
(1)从反应开始到平衡时,平均反应速率v(NH
(2)若改变某一条件使平衡向正反应方向移动,则v(正)( )。
a.不变 b.减小
c.增大 d.均有可能



(4)能说明反应达到平衡的是( )。
a.n(N2)和n(H2)之比保持不变 b.一个N
c.体系中气体密度保持不变 d.H2的减少速率,等于NH3的生成速率
e.体系中平均分子量保持不变 f.N2、H2、NH3的物质的量浓度相等
(5)第5min,若改变反应温度,则NH3的浓度不可能为 ( ) mol·L-1。
a.0.40 b.0.12 c.0.10 d.0.08
(6)在第5min将容器压缩一半体积,若在第8min达到新的平衡(NH3的浓度约为0.25 mol·L-1),请在上图中画出第5~9分钟内NH3浓度的近似变化曲线。
正确答案
(1)0.025mol/(L.min)
(2)d
(3)cd
(4)be
(5)ac(
(6)图见下
解析
解析已在路上飞奔,马上就到!
知识点
11.将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应
2A(g)+B(g)
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol/L
其中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下图表示反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.在一定温度、一定容积的密闭容器中,发生如下反应:H2(g)+I2(g)
(1)实验测得:1molH2分子中的化学键断裂时需要吸收436kJ的能量,1mol I2分子中的化学键断裂时需要吸收152.7kJ的能量,1molHI分子中的化学键形成时要释放298.7kJ的能量。则该反应的热化学方程式为 。
(2)在457.6℃时,反应体系中各物质的近似浓度的有关数据如下:
①在上述条件下,从反应开始直至t2时,氢气的平均反应速率为 ___________ 。
②在上述条件下,对于达到平衡状态的该可逆反应,下列说法正确的是___________。
A.达到平衡状态的标志之一是气体的密度不再变化
B.混合气体的颜色不再变化
C.向容器中充入氩气,正、逆反应速率都不变,化学平衡不移动
D.将容器的容积缩小为原来的一半,正、逆反应速率都加快,化学平衡发生移动
③根据表中数据,计算457.6oC时该反应的平衡常数K约为_______ (保留整数); 若ToC时该反应的平衡常数为0.25,则T____457.6oC(填“=”、“>”或“<”),ToC时将H2和I2各0.1mol的气态混合物充入10L密闭容器中,达到平衡时I2的转化率为 _________ 。
(3)25oC时,Ksp(PbI2)=8.49×10-9。将1mL l.0×10-3mol·L-1(CH3COO)2Pb溶液滴入 100mLl.0×10-3mol·L-1的HI溶液中,是否会产生PbI2沉淀?__________(填“是”或“否”)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式( ), 在图1中曲线( )(填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是( )
A.
B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)=( ),该温度下的平衡常数K= ( )。 若升高温度,K值变化( )(填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.请在下表空格中填入剩余的实验条件数据。
B.根据反应N2+ 3H2
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析