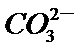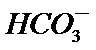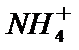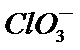- 化学反应原理
- 共2396题
3.下列解释事实的方程式不正确的是
正确答案
解析
A.碳酸钠属于强碱弱酸盐,碳酸根离子发生水解,故正确。
B.0.1 mol·L-1氨水因为是弱电解质,不能完全电离,因此PH小于13,故B正确。
C.“84消毒液”的有效成分次氯酸钠,而不是氯酸盐,故C错误。
D.合成氨是一个可逆反应,存在一定的限度,所以不能完全反应,故D正确。
考查方向
解题思路
判断盐类水解的条件及溶液酸碱性,弱电解质的电离特点、氯气的性质及其应用、可逆反应存在限度不能全部转化
易错点
“84消毒液”的有效成分不熟知,弱电解质的电离与PH的关系
知识点
13.25℃时,向100 mL 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )
正确答案
解析
a点时溶液中存在:NH4HSO4=NH4+ +H+ +SO42- 与NH4+ +H2O 


考查方向
解题思路
把握电离与水解的关系,影响溶液导电性的因素,掌握三大守恒的运用。
易错点
电荷守恒运用不当
知识点
4.根据下图所给信息,得出的结论正确的是( )
正确答案
解析
A.由图中信息:1mol的C完全燃烧生成1molCO2(s)时放出热量是bKJ,而燃烧热是生成1molCO2(g)时放出热量,所以碳的燃烧热小于b kJ/mol,故A错误;
B.根据图中信息:C(s) + O2(g) = CO2(s) △H = -bkJ/mol,CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,再根据盖斯定律:(-②)×2得出2C(s) + O2(g) = 2CO(g) △H = -2(b-a) kJ/mol,故B正确;
C.根据图中信息:CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,所以2CO2(s) = 2CO(g)+O2(g) △H = +2a kJ/mol,所以C错误;
D.生成气态CO2释放的能量要小于生成固态CO2释放的能量;根据图中信息:C(s) + O2(g) = CO2(s) △H = -bkJ/mol,所以生成气态CO2释放的能量要小于b kJ/mol,即 △H > -b kJ/mol,所以D错误;
考查方向
解题思路
A.根据图中信息可知,1mol的C完全燃烧生成1molCO2(s)时放出热量是bKJ,而燃烧热是生成1molCO2(g)时放出热量;
B.根据图中信息可知:C(s) + O2(g) = CO2(s) △H = -bkJ/mol,CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,再根据盖斯定律求解;
C.根据图中信息可知CO(g) +1/2O2(g)= CO2(g) △H = -a kJ/mol,所以2CO2(s) = 2CO(g)+O2(g) △H = +2a kJ/mol
D.生成气态CO2释放的能量要小于生成固态CO2释放的能量;
易错点
没有掌握燃烧热的实质,不能准确提取图中相关信息,释放能量越多,△H越小。
知识点
3、常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是( )
正确答案
解析
pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,A、①与②混合,由于平衡常数不变,CH3COOH、CH3COO-浓度均减半,则氢离子浓度不变,混合溶液的pH=3,c(H+)=0.001mol•L-1,故A错误;B、①和④混合后,醋酸过量,溶液中的溶质为CH3COOH和CH3COONa,故c(Na+)<c(CH3COO-)+c(CH3COOH),故B错误;C、②和③混合后,氨水过量,溶液中的溶质是NH3•H2O和NH4Cl,溶液显碱性,故有:c(H+)<c(OH-),根据电荷守恒可知:c(Cl-)<c(NH4+),故有:c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;D.将这四种溶液加水稀释100倍,促进醋酸和一水合氨电离,导致醋酸中氢离子浓度大于盐酸,氨水中氢氧根离子浓度大于氢氧化钠,但酸仍然是酸,碱仍然是碱,所以这四种溶液的pH大小顺序是:③>④>②>①,故D正确.
考查方向
解题思路
pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,A、①与②混合,CH3COOH浓度改变,pH变化;B、①和④混合后,醋酸过量;C、②和③混合后,氨水过量,溶液中的溶质是NH3•H2O和NH4Cl,根据电荷守恒来分析;D、根据酸、碱的相对强弱确定稀释后酸、碱的pH.
易错点
电解质的电离、酸碱混合溶液定性判断等知识点来分析解答,易错选项是B,注意二者等体积混合时,醋酸过量,溶液中的溶质为醋酸和醋酸钠,为易错点.
知识点
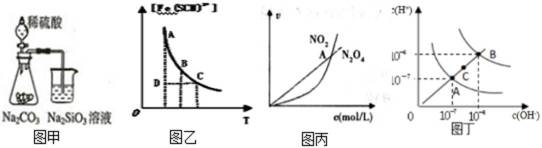
5.下列各示意图与对应表述正确的是()
正确答案
解析
比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱,故A正确;
反应处于D点时,从横坐标看T1温度下对应的平衡状态Fe(SCN)2+浓度比D点高,所以D点还未达到平衡,v(正)>v(逆),故B错误;
乙表示恒温恒容条件下发生的可逆反应2NO2(g)
从A点到C点水的离子积常数是增大的,所以改变的条件应该是升高温度,故D错误。
考查方向
解题思路
A:比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱;
B:反应处于D点时,从横坐标看T1温度下对应的平衡状态Fe(SCN)2+浓度比D点高,所以D点还未达到平衡,v(正)>v(逆);
C:乙表示恒温恒容条件下发生的可逆反应2NO2(g)
D:从A点到C点水的离子积常数是增大的,所以改变的条件应该是升高温度。
易错点
对非金属性强弱比较理解不透彻;对可逆反应及其相关知识理解不透彻;
知识点
11.氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.下列图示与对应的叙述相符的是
正确答案
解析
A.滴定开始时0.1 mol•L-1某碱pH<13,所以碱为弱碱,强酸滴定弱碱用甲基橙作指示剂,故A错误;
B.已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件是加入催化剂或前后气体系数不变的反应增大压强,故B错误;
C.由图可知CO(g)+2H2(g)⇌CH3OH(g)△H=419kJ/mol-510kJ/mol=-91kJ•mol-1,故C正确;
D.据金属镁与硫酸反应比铝与稀硫酸反应快,物质的量之比为2:3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)之比为4/9,故D错误;故选C.
考查方向
本题主要考查了中和滴定;反应热和焓变;化学反应速率与化学平衡图象的综合应用;镁的化学性质;铝的化学性质
解题思路
本题考查了图象分析方法,反应特征的应用,主要是反应热量变化,反应定量计算分析判断,中和滴定,题目难度中等.
A.根据盐酸在滴定开始时的pH来判断碱为弱碱,强酸滴定弱碱用甲基橙作指示剂;
B.已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件是加入催化剂或前后气体系数不变的反应增大压强;
C.利用△H=旧键断裂吸收的总能量-新键形成所放出的能量来分析;
D.据金属镁的活泼性大于铝以及镁、铝与足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,即可找出体积(V)与时间(t)的关系.
易错点
1、图象分析方法
2、反应定量计算分析判断
知识点
高铁酸盐在能源、环保等方面有着广泛的用途。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
18.该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn g(已知F=96500 C/mol)。
19.盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
20.图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
21.完成“氧化”过程中反应的化学方程式:
其中氧化剂是 (填化学式)。
22.加入饱和KOH溶液的目的是( )
23.已知25℃时Ksp[Fe(OH)3]=4.0×10。38,此温度下若在实验室中配制Smol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
正确答案
FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;0.2
解析
该电池放电时正极的电极反应式为FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;若维持电流强度为1A,电池工作十分钟,理论消耗Zn 0.2g(已知F=96500 C/mol)。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
右;左
解析
盐桥中盛有饱和KC1溶液,此盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
使用时间长、工作电压稳定。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O;NaClO
解析
Fe元素化合价由+3到+6,Cl元素由+1到到—1,在氧化还原反应中氧化剂和还原剂得失电子总数相等的。2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O故FeCl3、Na2FeO4计量数为2。NaClO和NaCl为3。
考查方向
本题主要考查了电解池电极反应式的书写,氧化还原反应的配平,化工工艺流程。
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
减小高铁酸钾的溶解,促进高铁酸钾晶体析出。
解析
加入饱和KOH溶液的目的是减小高铁酸钾的溶解,促进高铁酸钾晶体析出。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
正确答案
2.5
解析
K = [Fe3+] / [H+]3分子分母同时乘以[OH-]3,得K = [Fe3+][OH-]3 / [H+]3[OH-]3即K = Ksp / Kw3 = 2.794×10-39 / 10-14 3 = 2794为使配制过程中不出现浑浊现象,则至少需要加入2.5mL 2 mol/L的盐酸。
考查方向
解题思路
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
易错点
根据装置书写电极反应式 。
13.已知A和B在一定条件下可建立如下平衡:2A(g)+B(g)
(1)达到平衡所需时间是I ( ) Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是I( )Ⅱ。
(2)若测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为( )。
(3)计算500℃时该反应的平衡常数,写出计算过程。
(4)t1时刻分别向两容器的平衡体系中加入2 molC,在下列图示中,能正确反映此时两容器中C的体积分数随时间变化曲线的是 ( )(填序号)。
正确答案
(1)>(1分) >(1分)
(2)90%(2分)
(3)K=8100(计算过程略) (2分)
(4)A (2分)
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g)
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
② 该电池工作时,正极是 极(填“a”或“b”);
②该电池负极反应的离子方程式为 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是
正确答案
解析
A.依据判断AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐溶液的pH大于7,故A错误;
B.AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,溶液PH>7;BY的溶液pH=6.溶液呈酸性,所以AY溶液的pH值大于BY的pH,故B错误;
C.BX溶液的pH=4,BY溶液的pH=6,前者水解程度大于后者,加水促进水解,稀释相同倍数溶液pH值变化BX大于BY,故C错误;
D.AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱,BX的溶液pH=4,BY的溶液pH=6.溶液呈酸性,说明HY为弱酸,BOH为弱碱,所以电离平衡常数K(BOH)<K(HY),故D正确
考查方向
弱电解质电离、盐类水解
解题思路
AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱,BX的溶液pH=4,BY的溶液pH=6.溶液呈酸性,说明HY为弱酸,BOH为弱碱,依据判断的结果分析选项判断.
易错点
弱酸阴离子和弱碱阳离子的判断
教师点评
题考查了弱电解质电离、盐类水解,侧重于学生的分析能力的考查,题目难度中等
知识点
急性前壁心肌梗死易发生的心律失常类型为
A.室上性心动过速
B.房室传导阻滞
C.房性期前收缩
D.心房颤动
E.快速室性心律失常
正确答案
E
解析
急性前壁心肌梗死易伴发快速性心律失常,如室性心动过速、频发性、多源性室性早搏等,而下壁心肌梗死易发生缓慢心律失常,如:房室传导阻滞等。故选E.

8.如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:_______________;
9.有一种用CO2生产甲醇燃料的方法:CO2+3H2
已知:CO2(g)+3H2(g)
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
10.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
①实验2条件下平衡常数K= ________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时
V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。A.CO2减少的化学反应速率和CO减少的化学反应速率相等B.容器内气体压强保持不变C.CO、H2O、CO2、H2的浓度都相等D.容器中气体的平均相对分子质量不随时间而变化
正确答案
(1)SO2-2e-+2H2O=4H++SO42- (2分)
解析
SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+
考查方向
本题考查原电池原理
解题思路
SO2在负极失去电子转化为SO42-,根据电极反应式的书写方法来回答
易错点
根据化合价的变化分析得失电子,对应原电池中的两极反应
教师点评
本题考查原电池原理,是电化学中的重点内容,是高考中的重要考查点,题目难度中等,原电池原理的知识与氧化还原反应的知识交织在一起
正确答案
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O ΔH=-(3/2b+2c-a-d)kJ·mol-1 (2分)
解析
应用盖斯定律解题,△H=-△H1-△H2+



考查方向
本题考查热反应方程式的计算
解题思路
应用盖斯定律解题,始终抓住目标反应和已知反应之间的关系应用数学知识来解
易错点
盖斯定理的计算应用中,注意对方程式做适当的调整
教师点评
本题考查热反应方程式的计算,注意盖斯定理的应用,题目难度中等
正确答案
(3) ①1/6(或0.17) (2分) ΔH<0 (2分) ② >1 (2分) ③ > (2分)④ A
解析
①实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则
③900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol时,浓度商Qc=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆
④A.CO2减少的化学反应速率和CO减少的化学反应速率相等,证明正逆反应速率相等,达到了平衡,故正确;
B.反应前后气体系数和相等,容器内气体压强始终保持不变,所以压强不变的状态不一定平衡,故错误;
C.CO、H2O、CO2、H2的浓度相等,可能平衡也可能不平衡,故错误;
D.容器中气体的平均相对分子质量等于质量和物质的量的比值,质量和物质的量都不变化,所以容器中气体的平均相对分子质量始终不随时间而变化,此时的状态不一定是平衡状态,故错误.
考查方向
本题考查化学平衡计算、化学平衡影响因素、化学平衡状态的判定等
解题思路
①第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;利用三段式计算平衡时,各组分的物质的量,该反应是气体体积不变的反应,故利用物质的量代替浓度代入平衡常数表达式计算平衡常数;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率;
④当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,根据密度和平均相对分子质量的公式进行分析解答该题
易错点
平衡移动后转化率的计算,结合三段式的计算格式进行分析
教师点评
本题考查化学平衡计算、化学平衡影响因素、化学平衡状态的判定等,是高考中的重点考查内容,侧重考查学生对数据的分析及计算能力,注意对知识的理解与掌握,题目难度中等
13.在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )
正确答案
解析
A、如果n=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈碱性,所以n>1,故A错误;
B、b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;
C、c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-)=0.05mol/L,故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)+ c(NH4+)=0.5n,所以c(NH3•H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:
,故D正确
考查方向
本题考查了酸碱混合的定性判断及离子浓度大小比较
解题思路
A、如果n=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈碱性;
B、b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C、c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析解答;
D、25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.05)mol/L,然后结合铵根离子的水解平衡常数表达式计算
易错点
B项电离程度的比较
教师点评
本题考查了酸碱混合的定性判断及离子浓度大小比较, 在近几年的各省高考题中出现的频率较高,常与盐类水解、弱电解质电离、pH计算等知识交汇命题
知识点
下列描述违背化学原理的是
正确答案
解析
略。
知识点
扫码查看完整答案与解析