- 化学反应原理
- 共2396题
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
正确答案
解析
图像为从反应开始以后正反应速率的变化曲线,c点正反应速率达到最大值后开始减小,一定未达平衡,速率变化的过程不是平衡状态,A错;a点到b点正反应速率增加,反应物浓度随时间不断减小,反应物浓度:a点大于b点,B错;从a点到c点,为什么反应物的浓度是减小的,而速率在增加,因为该容器是绝热恒容密闭容器,只有反应是放热的,放出的热量在绝热容器中使反应物的温度升高,温度对反应速率的影响程度大,反应速率加快;c点后反应仍放热,但此时浓度减小对反应速率的影响增大,正反应速率随反应物浓度的减小而减小;依次反应是放热的,反应物的总能量高于生成物的总能量,则C错;a-b段的反应速率小于b-c段的,故相等的时间内,b-c段转化的SO2多,故D正确。
知识点
化合物


(1)已知




(2)反应


①列式计算实验a从反应开始至达到平衡时的反应速率 v(
②图中3组实验从反应开始至达到平衡时的反应速率v(
③用

正确答案
(1)
(2)①
②bca;加入催化剂。反应速率加快,但平衡点没有改变;温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的溶剂和起始物质的量未改变,但起始总压强增大)
③
解析
略。
知识点
在密闭容器中发生反应:X+3Y
正确答案
解析
略
知识点
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
有关物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率
平衡常数表达式为
(2),相同温度下,若开始加入
A,平衡常数
B,
C,达到平衡的时间
D,平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的 ( )
A,充入少量氨气
B,降温至0℃
C,充入少量硫化氢
D,加压
(4)常温下,将
① 浓度为
② 
③ 
则a、b、c、d之间由大到小的关系是: 。
(5)常温下,取
表示醋酸溶液中pH变化曲线的是 (填“A”或“B”);设盐酸中加入的Zn质量为



(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
A,在A、B间任一点,溶液中一定都有
B,在B点,
C,在C点:
D,在D点:
正确答案
(1)0.1mol/(L·min)
(2)BD
(3)A
(4)b>a=d>c
(5)B,<
(6)D
解析
略
知识点
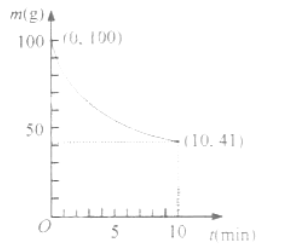
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)

完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、 。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如下图所示。Ni(CO)4在0~10min的平均反应速率为 。
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
A.平衡常数K增大
B.CO的浓度减小
C.Ni的质量减小
D.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
正确答案
(1)增大CO浓度,加压。
(2)0.05
(3)bc。
(4)把粗镍和CO放于一个水平放置的密闭的玻璃容器中,然后在低温下反应,一段时间后在容器的一端加热。
解析
(1)反应(1)是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温度不变的情况下采取可增大CO浓度,加压的方法提高产率;
(2)根据题意,反应的Ni为1mol,则生成

(3)反应(2)正向气体体积增大的吸热反应,降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆[
(4)根据反应①②的特点可提纯粗镍。
知识点
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)
正确答案
解析
略
知识点
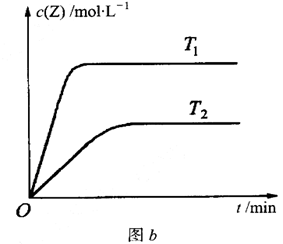
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如题7图所示。下列叙述正确的是( )
正确答案
解析
略
知识点
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) 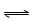
正确答案
解析
略
知识点
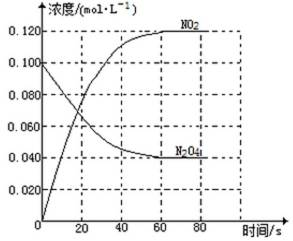
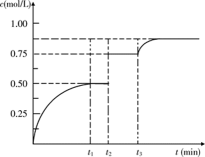
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
正确答案
(1)① 大于 ② 0.0010 ③0.36mol·L-1
(2)a:④大于
⑤ 反应正方向吸热,反应向吸热方向进行,故温度升高
b:⑥平衡时,c(NO2)= 0.120mol·L-1 +0.0020mol·L-1·S-2×10s×2=0.16mol·L-1
c(N2O4)=0.040 mol·L-1-0.0020 mol·L-4×10s=0.020 mol·L-1
K2= 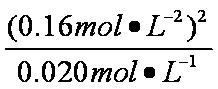
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
解析
略
知识点
工业上采用乙苯与
其中乙苯在
(1)上述乙苯与

(2)①乙苯与
②下列叙述不能说明乙苯与
a。
c,消耗


(3)在3L密闭容器内,乙苯与




别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。
①实验I乙苯在0-50min时的反应速率为_______________
②实验Ⅱ可能改变条件的是__________________________
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为
正确答案
(1)
(2)
(每空2分 共4分)
(3)①
②加入催化剂
③
(4)减小(2分);0.225 (2分)
解析
略
知识点
运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=________,该反应中的ΔH________0(填“>”“<”或“=”)。
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(l)发生反应,转化率随时间(f)变化如图。15-20min内,v(NH3)=________。若其他
(2) 25℃时,某同学将O.lmol


(3) 25℃时,向O.lmol




正确答案
(1)①
(2)>;>
(3)白色沉淀逐渐变成红褐色;Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+;2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)
解析
略。
知识点
在容积固定的容器中发生反应X(g)+Y(g) 
正确答案
解析
略
知识点
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)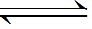
正确答案
解析
略。
知识点
一定温度下,将1mol X和1mol Y气体充入2 L恒容密闭容器,发生反应

正确答案
解析
略
知识点
Ⅰ,甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是 (填序号)
A,温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH) =(mol·L-1·min-1)
B,该反应在T1时的平衡常数比T2时的大
C,该反应为吸热反应
D,处于A点的反应体系从T1变到T2,达到平衡时减小
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为 ;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为
Ⅱ,已知Ksp(AgCl)=1.56×10-10 ,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 。
正确答案
答案:
Ⅰ(1)C+H2O
(2)CH3OH(l)+O2(g)= CO(g)+2H2O(l)H=-443.5kJ·mol-1
(3)AB
(4)1-
(5)CH3OH-6e-+8OH-=== CO32-+6H2O c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)> c(H+)
Ⅱ Br-、C1-、CrO42-
解析
略
知识点
扫码查看完整答案与解析