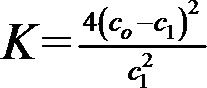- 化学反应原理
- 共2396题
grow
正确答案
9.2013年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:_____________________。
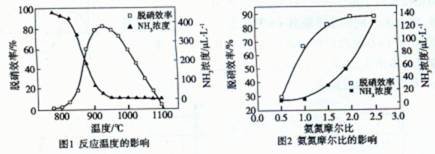
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),
反应原理为:NO(g) +NO2(g)+2NH3(g)
① 该反应的△S_____0,△H_____0(填“>”.“=”或 “<”)。
② 对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=___________。
③以下说法正确的是_______。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃ 和450℃ 左右脱氮
(4)NO2.O2和熔融NaNO3可制作燃料电池,其原理见右图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为________________________。
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO.NO2体积比为1:1)的质量为__________g。
正确答案
(1) b d
(2)CH4(g)+N2O4(g) ==N2(g) +2H2O(l) + CO2(g) △H= —898.1kJ/mol
(3)
① > <
②KP=
③ C
(4)NO2+NO3— —e-=N2O5
(5)76g
解析
解析已在路上飞奔,马上就到!
知识点
11.汽车尾气中,产生NO的反应为:N2(g)+O2(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14. 下列各表述与示意图一致的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应: A(g)+B(g) 
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12. 与下列图像有关的说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.使用SNCR脱硝技术的原理是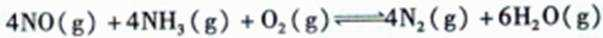
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.关于下列图示的说法中正确的是:()

① ② ③ ④
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.在容积为2L的密闭容器中,一定条件下发生如下反应
在其他条件不变的情况下,温度对反应的影响,如图所示(注:T1、T2均大于300℃);下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(1)反应
分别在三种不同实验条件下进行,它们的起始
c(B)=0.200 mol/L 、 c(C)=0 mol/L。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
Ⅰ.与①比较,②和③分别仅改变一种反应条件。
所改变的条件是:②_____________________;
③_____________________。
Ⅱ.实验②平衡时B的转化率为______;
Ⅲ.该反应的ΔH________0;
Ⅳ.该反应进行到4.0min时实验②的平均反应速率:v(B)=_________________;
(2)在一定条件下,二氧化硫和氧气发生如下反应:


①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反
应过程中SO2、O2、SO3物质的量变化如图,反应处于
平衡状态的时间段 ( ) 。
②据图判断,反应进行至20min时,曲线发生变化的原因
是(用文字表达)( )
③10min到15min的曲线变化的原因可能是( )
(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.向某恒容密闭容器中充入一定量CO2和H2,发生反应:
①正反应速率
②逆反应速率
③HCOOH(g)的浓度
④对应温度时的平衡常数
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.开发新能源、新材料是实现社会可持续发展的需要。请回答下列问题:
(1)下图是2LiBH4/MgH2体系放氢焓变示意图。
则:Mg(s)+2B(s)=MgB2(s) ΔH= 。
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图所示。下列说法正确的是 (填字母)。
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为CO(g)+2H2(g)
①在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示。
则:上述合成甲醇的反应为 反应(填“放热”或“吸热”)。平衡常数KA、KB、KC的大小关系为 。若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为 L。
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图。
当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图。
(4)次磷酸钴广泛应用于化学镀钴,工业上利用电解法制备次磷酸钴的电极材料为金属钴和不锈钢,其电解装置如图所示(其中阴离子交换膜只允许阴离子通过,其中阳离子交换膜只允许阳离子通过)。
则:①N极的电极反应式为: ;
②次磷酸钴在 区生成(填“Ⅰ、Ⅱ或Ⅲ”)
③已知次磷酸与足量氢氧化钠溶液反应的化学方程式为:H3PO2 + NaOH = NaH2PO2 + H2O,则NaH2PO2溶液中离子浓度由大到小的顺序为 。
正确答案
(1)-93KJ/mol
(2)AB
(3)
①放热 KA=KB>KC 2
② 如图
(4)
① 2H2O +2e- =H2 +OH- 或2H++2e- =H2
②Ⅰ
③c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
解析
解析已在路上飞奔,马上就到!
知识点
10.在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,下列叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.工业生产尿素过程中涉及的物质转化过程如下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为__________
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:_____________________
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
①若分别用



②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数__________(填“变大”“变小”或“不变”)。
③在

(4)



(5)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成
正确答案
(1)
(2)移走氨气,减小生成物的浓度,平衡右移,有利于氨的合成
(3)①< ②不变 ③66.7
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
12. 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析