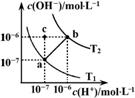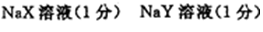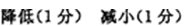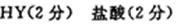- 化学反应原理
- 共2396题
在常温下,纯水中存在电离平衡H2O


正确答案
解析
略
知识点
如图表示水溶液中c(H+)和c(OH-)的关系,下列说法正确的是
正确答案
解析
略。
知识点
下列说法正确的是
正确答案
解析
略
知识点
2.374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水( )
正确答案
解析
略
知识点
W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,其简单离子都能促进水的电离的是
正确答案
解析
略
知识点
水处理技术在生产、生活中应用广泛。
(1)含有较多_______离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为_______(写一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应该先使硬水通过_______(填“RH”或“ROH”)型离子交换树脂,原因是_______。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为_______。电渗析法净化水时,使离子通过半透膜的推动力是_______。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的_______。
正确答案
(1)Mg2+、Ca2+;Ca2++2HCO3-=CaCO3↓+H2O+CO2↑,或Mg2++2HCO3-=MgCO3↓+H2O+CO2↑。
(2)HR;先通过阴离子交换膜可能产生等沉淀而影响树脂交换效果
(3)反渗透法;电势差(或电场力)
(4)电导率(或电阻率)
解析
(1)硬水是含Mg2+、Ca2+较多的水;暂时硬水加热时的分解反应为:Ca2++2HCO3-=CaCO3↓+H2O+CO2↑,或Mg2++2HCO3-=MgCO3↓+H2O+CO2↑。
(2)应先通过阳离子交换剂 HR ;后通过阴离子交换剂 ROH;若先通过阴离子交换树脂,SO42- + ROH = RSO4 + OH-,生成的OH-发生:Mg2+ + 2OH- = Mg(OH)2,能使交换膜发生堵塞。
(3)反渗透又称逆渗透,一种以压力差为推动力,从溶液中分离出溶剂的膜分离操作。因为它和自然渗透的方向相反,故称反渗透。电渗析法的是利用离子交换膜在电场作用下,分离盐水中的阴、阳离子,从而使淡水室中盐分浓度降低而得到淡水的一种膜分离技术。电渗析装置是利用离子在电场的作用下定向迁移,通过选择透过性的离子交换膜达到除盐目的。
(4)水中的离子浓度越小,导电性越差,故可通过测量溶液的电导率来检验蒸馏水的纯度。
知识点
如图表示水溶液中

正确答案
解析
略
知识点
水是极弱的电解质,改变外界条件对水的电离有促进或抑制作用,下列说法错误的是
正确答案
解析
略
知识点
常温下的两种溶液:① pH=9的NaOH溶液,
②pH=9的CH3COONa溶液。
对这两种溶液的判断,正确的是
正确答案
解析
略
知识点
以下事实中能证明某无色透明液体是纯水的是
正确答案
解析
略。
知识点
常温下,将

正确答案
解析
略。
知识点
10.常温下,某溶液中由水电离出的c(OH—)=1×10-11mol/L,则下列各选项中每种溶液均有可能的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. A、B、C、 D、 E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:Ⅰ.将1 L pH=2的A溶液分别与0.01mol/L V1L B溶液、0.01mol/LV2L D溶液充分反应至中性,V2<V1;Ⅱ.浓度均为0.1mol·L-1A和E溶液,pH:A<E;Ⅲ.浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:
(1)D分别是( )。
(2)常温下用水稀释0.1 mol/L B时,溶液中随着水量的增加而减小的是( )(填序号)
①c(H+)和c(OH-)的乘积 ②OH-的物质的量 ③
(3)等体积pH相同的A和E溶液,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填序号)
①开始反应时的速率A>E ②反应过程的平均速率 E>A
③反应所需要的时间E>A ④参加反应的锌粉物质的量A=E
⑤E溶液里有锌粉剩余 ⑥A溶液里有锌粉剩余
(4)用Pt电极电解A溶液,阳极的电极反应式为 ( )。
(5)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不发生分解) ,溶液pH随温度变化如下图中的_________曲线(填写序号) 。
(6)常温下,向0.01mol mol/L C溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为( )。
正确答案
(1)NaOH
(2)③
(3)②④⑥
(4)2Cl--2e-=Cl2↑
(5) ④
(6)
解析
解析已在路上飞奔,马上就到!
知识点
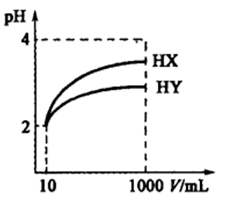
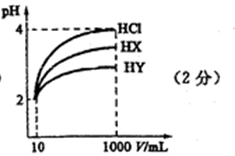
28.常温下,10 mL pH均为2的HX、HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如右图所示:
请回答下列问题:
(1)在图中用曲线表示将10 mL pH=2的盐酸加水稀释到1000 mL的过程中溶液pH变化趋势。
(2)物质的量浓度均为
(3)常温下,
(4)若HX、HY均为非氧化性酸,在上述稀释后的HX、HY和盐酸三种溶液中加入足量相同规格的铁粉,则产生氢气的速率最快的是 ( ),产生氢气体积最少的是 ( )。
(5)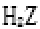

正确答案
(1)
(2)
(3)
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
13.能促进水的电离,并使溶液中的c(H+)>c(OH—)的操作是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析