- 化学反应原理
- 共2396题
3.0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是
正确答案
知识点
21. 高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:2K2FeO4+16HCl→4 KCl+2FeCl3+8 H2 O+3Q↑,下列说法不正确的是
正确答案
解析
A.Q为氯气,可用湿润的淀粉碘化钾试纸检验产物氯气,故A正确;
B.K2FeO4在水中的电离方程式为K2FeO4═2K++FeO42-,故B错误;
C.反应中16molHCl参加反应只有6mol被氧化,则反应中氧化剂与还原剂的物质的量之比为1:3,故C正确;
D.产物Q为氯气,氯气为单质不是电解质,所以反应中涉及的物质中有5种为电解质,故D正确;
考查方向
氧化还原反应
解题思路
已知2K2FeO4+16HCl═4KCl+2FeCl3+8H2O+3Q↑,根据元素守恒可知Q为氯气,Fe元素的化合价由+6价降低为+3价,Cl元素的化合价-1价升高为0价,以此来解答
易错点
C项中16molHCl参加反应只有6mol被氧化
教师点评
本题考查氧化还原反应、电解质的概念、物质的检验等,把握反应中元素的化合价变化为解答的关键,考查点较多,题目难度不大
知识点
12.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(1)用热水配制AlCl3溶液,会出现浑浊现象,原因是(用离子方程式和必要的文字说明):( )。要消除浑浊现象,又不污染药品,可加入适量的__________溶液。
(2)常温下,有①0.01 mol/L HCl溶液;②pH=12的氨水,其中水的电离程度①()②,(选填“>”、“<”或“=”);若将①、②混合后所得溶液pH=7,则消耗溶液的体积:①()②(选填“>”、“<”或“=”)。若用①来滴定未知浓度的氨水,通常选用____________作指示剂,达滴定终点时各离子浓度由大到小的顺序是_________________________________。
(3)某温度(T℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则在该温度下,将100 mL 0.2 mol·L-1的稀盐酸与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH=( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.常温下,下列关于溶液pH的计算错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.某温度下,向PH=6的纯水中加入一定量的盐酸,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.常温下,下列关于溶液pH的计算错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5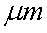
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
根据表中数据判断试样的pH=( )。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H20 (g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:( )。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是( ) 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=( ) 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 ( ) 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 ( ) 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,
2CO(g)=2C(s)+O2(g)
已知该反应的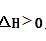
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.在新制的氯水中存在下列平衡:C12+H2O H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.常温下,电解某溶液x只生成H2和O2,下列有关电解过程的叙述正确的是( )(均在常温下讨论)①x溶液浓度可能增大 ②x溶液浓度可能减小 ③x溶液浓度可能不变 ④x溶液pH可能增大 ⑤x溶液pH可能减小 ⑥x溶液pH可能不变
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) 
正确答案
BD
知识点
已知:I2+2
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入________调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________;
过滤后,将所得滤液低温蒸发.浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是_______________。
(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。
正确答案
见解析。
解析
(1)因为要得到纯净的CuCl2•2H2O晶体,所以不能加入含Cu2+以外阳离子的物质来调节溶液的pH,所以可加入CuO.Cu(OH)2.Cu2(OH)2CO3等难溶于水的碱性物质;pH=4时,c(OH-)=10-10,c(Fe3+)=Ksp[Fe(OH)3]/c(OH-)3=2.6*10-9mol/L
(2) 
(3)2Cu2++4I-=2CuI↓+I2,所以选择淀粉作指示剂,终点时待测液由蓝色变为无色且半分钟内不恢复为蓝色,根据反应方程式可以得到如下关系:CuCl2•2H2O~ Na2S2O3,
所以试样中CuCl2•2H2O的质量百分数=0.1000 mol/L*0.02000L*171g/mol/0.36g=95%
知识点
下列有关实验装置进行的相应实验,能达到实验目的的是
正确答案
解析
本题属于基础实验与基本实验操作的考查范畴。
A图1所示装置中氢氧化钠会与Cl2反应。
B NH4Cl晶体受热分解,会“假升华”。
C纯碱是可溶性固体,不能用此装置,改在圆底烧瓶和分液漏斗的组合中进行。
D用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层,有机层从下口放出,水层从上口倒出,实现分液。
本题以常见气体制取、蒸干、除杂、萃取、分液为实验操作为素材,考查学生对实验操作的熟悉程度和实验原理的应用能力,试图引导中学化学教学关注化学实验操作的真实性。
知识点
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为________。
(2)室温下向10mL 氨水溶液中加水稀释后,下列量增大的有________(填编号,下同),减小的有________,不变的有________。
a.溶液中离子浓度
b.氨水的电离程度
c.水的离子积常数
d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”或“不相同”),其原因是________。
正确答案
(1)SO32-+H2O
(2) b,d;a;c
(3)相同;Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同
解析
略。
知识点
33.NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为( )
(2)按图13装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是( ),原因是( ),稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是( ) 。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究 ( )对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为( )(只列出算式,忽略水自身电离的影响)。
正确答案
(1)ACG
(2)①产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,氯化铵小颗粒形成白烟。②烧杯中的石蕊溶液会倒流进入到B瓶中。
(3)①温度
②
③(10-Y×5.35)/m
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析






















