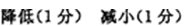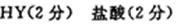- 化学反应原理
- 共2396题
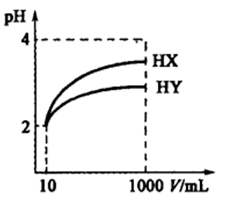
5.下列指定反应的离子方程式正确的是( )
正确答案
知识点
8.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是
正确答案
知识点
10.关于下列各装置图的叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:( )
加入锡粉的作用是:( )
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3) 检验沉淀已经“洗涤”干净的操作是:( )(3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH( )。(已知:Ksp[Sn
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:( )。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
( )。
正确答案
(1)抑制Sn2+水解, 防止Sn2+被氧化
(2)SnCl2 + Na2CO3 = SnO + CO2↑+2NaCl
(3)取少量最后
(4)小于1 (若写成≤1给1分)
(5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
解析
解析已在路上飞奔,马上就到!
知识点
23.25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.关于氯化铵溶液,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
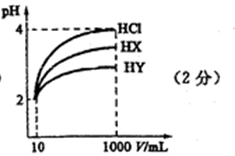
28.常温下,10 mL pH均为2的HX、HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如右图所示:
请回答下列问题:
(1)在图中用曲线表示将10 mL pH=2的盐酸加水稀释到1000 mL的过程中溶液pH变化趋势。
(2)物质的量浓度均为
(3)常温下,
(4)若HX、HY均为非氧化性酸,在上述稀释后的HX、HY和盐酸三种溶液中加入足量相同规格的铁粉,则产生氢气的速率最快的是 ( ),产生氢气体积最少的是 ( )。
(5)

正确答案
(1)
(2)
(3)
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
12.对于常温下0.0lmol/L的氨水,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列过程或现象与盐类水解无关的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列过程或现象与盐类水解无关的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是( )
正确答案
知识点
9.向新制氯水中加入少量下列物质,能增强溶液漂白能力的是
正确答案
解析
在氯水中存在反应: 若反应使溶液中c(HClO)增大,则溶液的漂白性会增强。A.由于酸性HCl>H2CO3>HClO, 所以向溶液中加入碳酸钙粉末, 会发生反应2HCl+CaCO3=CaCl2+H2O+CO2↑,使化学平衡正向移动,导致c(HClO)增大,则溶液的漂白性会增强, 正确; B.若加入稀硫酸,使溶液中c(H+)增大,平衡逆向移动,溶液的漂白性减弱,错误; c 加入氯化钙溶液,不能发生反应,溶液的水对氯水起稀释作用,使溶液的漂白性减弱,错误; D.加入二氧化碳的水溶液,电离产生氢离子,使化学平衡逆向移动,溶液的漂白性减弱,错误;
考查方向
解题思路
新制氯水中漂白能力取决于HClO的浓度。
易错点
不能利用平衡移动的原理分析HClO的浓度增大的措施。
知识点
9.Ⅰ.(6分)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.(12分)磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
正确答案
Ⅰ.(1)反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气。
(2)Al2O3 +2OH−
(3)NH4Cl+H2O 

Ⅱ.(1)S、Fe Fe3S4
(2)制印刷电路板
知识点
3.下列反应可用离子方程式“H++OH−=H2O” 表示的是
正确答案
知识点
能正确表示下列反应的离子方程式是
正确答案
解析
A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
知识点
扫码查看完整答案与解析