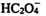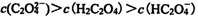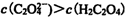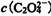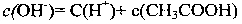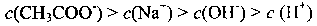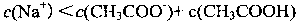- 化学反应原理
- 共2396题
6. 在25℃ 时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,
下列关系式中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.已知HCN的电离常数K=6.2×10-10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性。则下列关系式正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
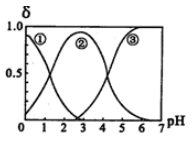
12.在H2C2O4(草酸)水溶液中,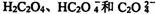
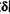
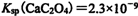
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12. 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4
溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度
关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液
(假设无损失),
①( ) 和( ) 两种粒子的物质的量之和等于0.1mol。
②( ) 和( ) 两种粒子的物质的量之和比OH―多0.05mol。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中
各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是( ),上述离子浓度大小
顺序关系中正确的是(选填序号)( ) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 ( ) 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)( )c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后
溶液中c(NH4+)与c(Cl-)的关系c(NH4+)( )c(Cl-)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.25°C时醋酸钠溶液中下列关系式正确是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是 ()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.氢气的制取与储存是氢能源利用领域的研究热点。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.25 ℃时,浓度为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.下列判断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2- )。
根据图示判断,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列溶液中各微粒的浓度关系正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知温度T时,水的离子积常数为KW,该温度下将V1mL a mol•L-1的一元酸HA与V2mL b mol•L-1的一元碱BOH充分混合,下列判断一定正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析