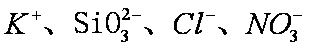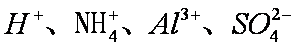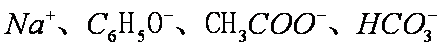- 化学反应原理
- 共2396题

正确答案
解析
A.未加氢氧化钠时,相同浓度溶液中,HX的lg

B.a点溶液lg
C.c点溶液lg
D.HY为0.01mol,b点进入NaOH为0.008mol,二者按物质的量1:1反应,故HY有剩余,故D错误.
故选:C.
考查方向
酸碱混合时的定性判断及有关ph的计算
解题思路
A.由于c(H+)×c(OH﹣)=Kw,lg
B.a点溶液lg
C.c点溶液lg
D.HY为0.01mol,b点进入NaOH为0.008mol,HY有剩余.
易错点
本题容易在离子浓度计算方面出错
教师点评
本题考查酸碱混合溶液酸碱性判断及溶液中离子浓度大小比较,涉及盐类的水解和弱酸的电离等,题目难度中等,侧重于考查学生的分析能力和计算能力
知识点
4.常温下向10 mL 0.1 mol·L-1 HN3(叠氮酸)溶液中逐滴滴加0.2 mol·L-1的NaOH溶液,
溶液pH的变化曲线如右下图所示(溶液混合时体积的变化、温度忽略不计,HN3的
Ka=10-4.7)。下列说法不正确的是( )
正确答案
考查方向
本题考查了酸碱中和滴定,溶液的酸碱性以及盐类水解等知识点。
解题思路
A选项正确,根据图像可知,沿横坐标PH呈增大趋势,及氢离子浓度减小,根据Kw不变,氢氧根离子浓度增大。
B错误,叠氮酸是弱酸,滴定终点溶液显弱碱性,而甲基橙的在4.4已经变色,还没有到达滴定的终点,误差较大。
C正确,为HN3和NaN3物质的量浓度相等的混合溶液,溶液呈酸性,HN3电离大于NaN3水解
D正确。为NaN3溶液,根据物料守恒得c(Na+)=c(N3-)+c(HN3))=1/15 mol·L-1(0.2mol/L×5ml÷15ml)
教师点评
本题考查了酸碱中和滴定,溶液的酸碱性以及盐类水解等知识点以及图像分析的能力,难度较大,在高考中出现频率中等,
知识点
常温下,下列各组离子在制定溶液中一定能大量共存的是
正确答案
解析
本题以溶液中离子共存的方式考查学生对硝酸的氧化性、亚铁离子还原性、甲基橙呈红色水溶液的呈酸性、酸性溶液AlO2-不能在其中共存、与铝反应产生大量氢气有强酸碱性两种可能等相关知识的理解程度,考查学生综合运用所学化学知识解决相关化学问题的能力。
知识点
下表各组物质中,能满足右图所示一步转化关系的是
正确答案
解析
略
知识点
将足量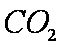
正确答案
解析
碳酸的酸性大于硅酸,A项中SiO32-不能大量共存;C中的OH-和CO2反应;D中C6H5O-会和CO2反应形成苯酚,故只有B中离子还能大量共存。答案选B。
知识点
下列关于电解质溶
正确答案
解析
本题考查常见离子的
知识点
6. 在25℃ 时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,
下列关系式中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)
下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
下列说法正确的是
正确答案
解析
水的离子积常数只与温度有关,温度越高,Kw越大,A错;SO2通入碘水中被I2氧化生成SO42-,B错;加入铝粉能产生H2的溶液可能是强酸性溶液,也可能可能是强碱性溶液,在强酸性溶液中不可能存在AlO2―和NO3-(硝酸与铝反应不生成氢气),在强碱性溶液中,C中离子互不反应,可以大量共存,C正确;100℃时,Kw=1×10-12,所以pH=2的盐酸c(H+)= 0.01mol/L,pH=12的NaOH溶液的c(OH―)=1mol/L,等体积混合时碱过量,溶液显碱性,D错。
知识点
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
正确答案
解析
本题考查离子(或离子与分子)的共存问题,同时考查考生应用知识解决实际问题的能力。本题不能共存所涉及的离子方程式均源于教材中的反应:
B选项:因SiO32-+CO2+H2O==H2SiO3↓+CO32-,故通入CO2后溶液中不能大量存在SiO32-;
C选项:Fe2+与Cl2因发生氧化还原反应不能大量共存;
D选项:Ag+与NH3•H2O不能大量共存(银氨溶液的配制)。
A选项通入CO2前后各离子均能大量共存,此外,本选项涉及的CO2能否与Ca2+反应生成CaCO3沉淀是很多考生常犯的错误。
知识点
下列各组离子在指定溶液中能大量共存的是
正确答案
解析
本题考查氧化还原反应以及离子反应等知识。
A氯水会氧化

知识点
常温下,下列各组离子在指定溶液中能大量共存的是
正确答案
解析
略
知识点
能在溶液中大量共存的一组离子是
正确答案
解析
略
知识点
扫码查看完整答案与解析