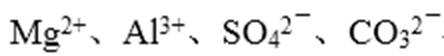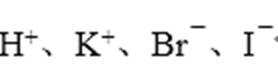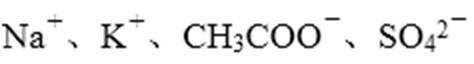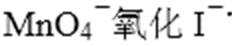- 化学反应原理
- 共2396题
12.制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
正确答案
解析
A中过量的氯气在不能有Fe2+,错误;B中Fe2+、H+、ClO-不能共存,错误;C中Fe2+、NH4+、OH-不能共存,错误;只有D中各离子互不反应,可以共存。
考查方向
解题思路
离子共存不仅要考虑组内离子之间的反应,还要结合题干提供的信息。
易错点
搞不清楚离子反应的规律和“离子共存”的条件,不会从复分解反应、氧化还原反应、双水解反应、络合反应等几个方面全面考虑、比较、归纳整理。
知识点
19.已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32- 、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
正确答案
解析
溶液本身无色,说明没有Fe2+。加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-。由于SO32-的还原性比I-强,故I-是否存在无法判断。因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有。故选BC。
考查方向
解题思路
溶液中常见的有色离子有四种:Cu2+蓝色、MnO42-紫色、Fe2+浅绿色、Fe3+黄色。离子共存题还要考虑电荷守恒问题。
易错点
常见的错误点有:未掌握当溶液中同时存在几种还原性离子,向其中加入氧化剂时还原性强的离子首先被氧化,常见离子的还原性:S2->SO32->Fe2+>I->Br-;没有注意题目中的隐含信息,如“无色”、“酸性”、“一定”、“等物质的量”等。
知识点
15.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol •L-1,向该溶液中逐滴加入0.010 mol •L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
正确答案
解析
根据溶度积规则知,析出AgCl沉淀时溶液中c(Ag+)= Ksp(AgCl)/ c(Cl-)=1.56×10-10/0.01mol/L=1.56×10-8mol/L;析出AgBr沉淀时溶液中c(Ag+)= Ksp(AgBr)/ c(Br-)=7.7×10-13/0.01mol/L=7.7×10-11mol/L;析出Ag2CrO4沉淀时溶液中c(Ag+)=[ Ksp(Ag2CrO4)/ c(CrO42-)]1/2=3×10-5 mol/L,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-;故选D。
考查方向
解题思路
根据溶度积规则知,析出AgCl沉淀时溶液中c(Ag+)= Ksp(AgCl)/ c(Cl-)=1.56×10-10/0.01mol/L=1.56×10-8mol/L;析出AgBr沉淀时溶液中c(Ag+)= Ksp(AgBr)/ c(Br-)=7.7×10-13/0.01mol/L=7.7×10-11mol/L;析出Ag2CrO4沉淀时溶液中c(Ag+)=[ Ksp(Ag2CrO4)/ c(CrO42-)]1/2=3×10-5 mol/L,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-;
易错点
在一定温度下,在难溶化合物的饱和溶液中组成沉淀的各离子的浓度的乘积是一常数,称溶度积常数。运用Ksp的公式进行计算,只要注意到AgCl、AgBr和Ag2CrO4的Ksp表达式不同,计算银离子的浓度即可。
知识点
3.在室温下的所给溶液中,下列粒子一定能够大量共存的是
正确答案
解析
A.H+、Fe2+、NO3-离子之间发生氧化还原反应,则不能共存,故A错误;B.甲基橙呈红色的溶液表明溶液呈酸性,存在大量H+,与AlO2-反应可以生成Al(OH)3沉淀或Al3+,所有不能共存;故B错误;C.pH=l的溶液,显酸性,CH3CH2OH、Cr2O72-发生氧化还原反应,故C错误;D.由水电离出的c(H+)=1.0×10-13mol/L的溶液,为酸或碱溶液,Ba2+、K+、Cl-、NO3-既不相互之间不反应,且不能与酸又能与碱反应,所以可以共存;故D正确
考查方向
解题思路
A.H+、Fe2+、NO3-离子之间发生氧化还原反应;B.甲基橙呈红色的溶液表明溶液呈酸性,存在大量H+,与AlO2-不能共存;C.pH=l的溶液,显酸性,CH3CH2OH、Cr2O72-发生氧化还原反应,D.由水电离出的c(H+)=1.0×10-13mol/L的溶液,为酸或碱溶液,Ba2+、K+、Cl-、NO3-既不能与酸又能与碱反应,且相互之间不反应;
易错点
忽视限定条件,如酸性溶液(H+)、碱性溶液(OH-),不能正确理解由水电离的c(H+)=1.0×10-13mol/L这一隐含的酸碱性条件。
知识点
3.室温下,下列各组离子在指定溶液中一定不能大量共存的是
正确答案
解析
A.H+、Na+、SO42-、Cu2+之间不发生发反应,所以可以共存,A错误;
B.Kw/c(OH-)=1 mol·L-1的溶液为酸性溶液,CO32-在酸性溶液中不能共存,B正确;
C.NaHSO4溶液为酸性溶液,NO3-在酸性条件下和Fe3+都具有氧化性,在溶液中能大量共存,故C错误;
D.能使甲基橙显黄色的溶液可能呈酸性、中性或者碱性,Ca2+、Ba2+、Br-、C1-在酸性、中性或者碱性都不发生化学反应,可以共存,所以D错误。
考查方向
解题思路
A.H+、Na+、SO42-、Cu2+之间不发生发反应;
B.Kw/c(OH-)=1 mol·L-1的溶液为酸性溶液,
C.在0.1 mol·L-1NaHSO4溶液为酸性;
D.能使甲基橙显黄色的溶液可能呈酸性、中性或者碱性;
易错点
不能有效判断习题中的隐含信息,忽略离子之间的氧化还原反应。
知识点
12.常温下,下列各组离子一定能在指定溶液中大量共存的是
正确答案
解析
A.是的酚酞变红的溶液为碱性,因此溶液中存在大量的OH-,Al3+不能大量共存;
B.
C.与Al反应能放出H2的溶液可能是强酸性或者强碱性溶液,如果是强碱性溶液则Fe2+不能大量共存,如果是强酸性溶液,溶液中存在NO3﹣会具有强氧化性,与Al反应生成氮的氧化物;
D.水电离的c(H+)=1×10﹣13mol•L﹣1的溶液可见水的电离是被抑制,因此溶液为强酸性或强碱性,若为强酸性AlO2﹣、CO32﹣不能大量共存
考查方向
解题思路
离子共存需要考虑离子反应条件、溶液的酸碱性、双水解、氧化还原、常见强氧化性离子与常见还原性的离子
易错点
离子反应条件不清、溶液酸碱性与PH的关系,KW的意义
知识点
8.常温下,下列各组离子在指定溶液中,一定可以大量共存的是
正确答案
解析
A 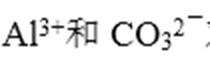
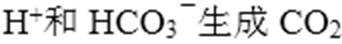
考查方向
解题思路
无色代表无铜离子这样的有色离子,PH=1代表氢离子参与共存
易错点
易忽略题目中所给的酸碱等环境因素
知识点
4.在下列溶液中,各组离子一定能够大量共存的是
正确答案
解析
A.MnO4-为有色离子,不满足溶液无色的条件,A错误;B.水电离出的=10-14mol/L溶液为酸性或者碱性溶液,Fe2+、Mg2+在碱性溶液中不能大量共存,B错误;C.加入铝能产生H2的溶液为酸性或者碱性溶液,在酸性溶液中I-、NO3-发生氧化还原反应,不能够大量共存,C错误;D.常温下c(OH-)=10-13mol/L的溶液为酸性溶液,在溶液中一定能大量共存,D正确;故选D。
考查方向
解题思路
A.无色溶液中不存在有色的高锰酸根离子;B.水电离出的=10-14mol/L溶液为酸性或者碱性溶液;C.加入铝能产生H2的溶液为酸性或者碱性溶液;D.常温下c(OH-)=10-13mol/L的溶液为酸性溶液;
易错点
本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性、溶液的颜色、溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”、是“可能”共存,还是“一定”共存等。
知识点
9.下列各组离子在溶液中能大量共存,通入足量括号中气体后仍能大量共存的是
正确答案
解析
A.NH4+、Mg2+、SO42-、Cl-该组离子之间不反应,可大量共存,通入氨气生成氢氧化镁沉淀,错误;
B.Na+、Ba2+、Cl-、NO3- 该组离子之间不反应,可大量共存,通入二氧化硫仍不反应,能在硝酸的氧化作用下,生成硫酸钡白色沉淀,错误;
C.Na+、Ca2+、ClO-、NO3-该组离子之间不反应,可大量共存,通入氯化氢生成氯气,错误;
D.K+、Fe3+、NO3-、SO42-该组离子之间不反应,可大量共存,通入氯气仍不反应,能大量共存,正确;故选D。
考查方向
解题思路
A.NH4+、Mg2+、SO42-、Cl-该组离子之间不反应,可大量共存,通入氨气生成氢氧化镁沉淀;
B.Na+、Ba2+、Cl-、NO3- 该组离子之间不反应,可大量共存,通入二氧化硫仍不反应,能在硝酸的氧化作用下,生成硫酸钡白色沉淀;
C.Na+、Ca2+、ClO-、NO3-该组离子之间不反应,可大量共存,通入氯化氢生成氯气;
D.K+、Fe3+、NO3-、SO42-该组离子之间不反应,可大量共存,通入氯气仍不反应,能大量共存;
易错点
在酸性条件下,硝酸根离子有氧化性
知识点
2.下列说法不正确的是()
正确答案
解析
Na+、SO42-、Fe3+、MnO4-之间不反应,在溶液中可以大量共存,故A正确;
晶体中HSO4-不电离,故只有0.1mol阳离子,即K+,因此阳离子所带电荷数为NA ,故B正确;
235U和238U质子数相同、中子数不同,互为同位素,化学性质基本相同,235U转化成238U是核反应,不属于化学变化,故C正确;
元素O、S、P的气态氢化物热稳定性依据非金属性判断,应该以此递减,故D错误。
考查方向
解题思路
A:Na+、SO42-、Fe3+、MnO4-之间不反应,在溶液中可以大量共存;
B:晶体中HSO4-不电离,故只有0.1mol阳离子,即K+,因此阳离子所带电荷数为NA;
C:235U和238U互为同位素,化学性质基本相同,235U转化成238U是核反应,不属于化学变化;
D:元素O、S、P的气态氢化物热稳定性依据非金属性判断,应该以此递减。
易错点
忽略离子共存的溶液条件;对阿伏伽德罗理解不透彻,对同位素及元素周期律概念混淆;
知识点
5.常温下,下列各组离子在指定溶液中一定能大量共存的是
正确答案
解析
A.硝酸将Fe2+氧化为Fe3,H+、Fe2+、NO3-不能共存,故A错误
B. c(OH-)=10-2 mol·L-1,呈碱性,能大量共存,故B正确
C. 酸性条件,Ag(NH3)2-和Cl-、SO42-反应生成沉淀,不能大量共存,故C错误
D. ClO-能氧化SO32-、S2-,不能大量共存,故D错误
故本题选择B
考查方向
解题思路
A.硝酸将Fe2+氧化为Fe3,H+、Fe2+、NO3-不能共存
B. c(OH-)=10-2 mol·L-1,呈碱性,能大量共存;
C. 酸性条件,Ag(NH3)2-和Cl-、SO42-反应生成沉淀,不能大量共存
D. ClO-能氧化SO32-、S2-,不能大量共存。
易错点
不会根据c(H+)/c(OH-)=10-10判断溶液的酸碱性
知识点
扫码查看完整答案与解析