- 化学反应原理
- 共2396题
4.己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成18g水,则放出的热量约为
正确答案
知识点
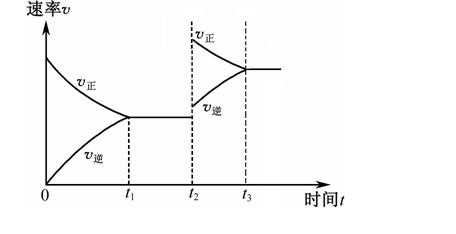
24.下列图示与对应的叙述相符的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.(1)一定温度下,向某容积固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
① (NH4)2S(s) 
② H2S(g) 
达到平衡时测得H2S和H2物质的量浓度分别为4 mol·L-1和1mol·L-1。则反应①的化学平衡常数K= 。
(2)25℃时,向20 mL 0.1mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,当NaOH溶液分别加到:①10 mL、②20 mL、③c (Na+)=c (CH3COO-)、④40 mL时,下列说法正确的是 。(填序号)
A.①中溶液显酸性,则c(Na+)>c(CH3COOH)
B.②中存在c (CH3COOH)+ c (CH3COO-)=0.05mol·L-1
C.③中混合溶液体积大于40 mL
D.④中水电离出的c(H+)最大
(3)密闭容器中发生下列反应:A(g)+B(g) 
(4)已知1.6 g液态甲醇在室温时完全燃烧放出的热量为68.4 kJ,则该条件下甲醇燃烧的热化学方程式为 。
若将甲醇的燃烧反应设计成原电池装置,能量的利用率会更高,当电解质溶液为酸性时,该电池负极的电极反应式为 。
(5)室温时,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2 mol · L-1,如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为 。
正确答案
(1)400
(2)AB
(3)
(4)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H= -2736kJ·mol-1
CH3OH-6e-+H2O=CO2+6H+
(5)1.45×10-4mol · L-1
解析
略
知识点
下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C—H键:413.4 kJ·mol﹣1、H—H键:436.0 kJ·mol﹣1。则下列叙述正确的是
正确答案
解析
略
知识点
一些烷烃的燃烧热( kJ/mol)如下:
下列推断正确的是
正确答案
解析
略
知识点
13.关于下列各图的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如右图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。据此作答:
(1)电解食盐水时,总反应的离子方程式是( ) 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:( ) 。
(3)已知:① Mg(s) + Cl2(g) = MgCl2(s),ΔH=-641 kJ/mol;
② Ti(s) + 2Cl2(g) = TiCl4(s),ΔH=-770 kJ/mol;
下列说法正确的是(选填字母)( ) 。
a.Mg的燃烧热为641 kJ/mol
b.Ti的能量一定比TiCl4高
c.等质量的Mg(s)、Ti(s)与足量的氯气反应,前者放出的热量多
d.Mg还原TiCl4的热化学方程式为:
2Mg(s) + TiCl4(s) = 2MgCl2(s) + Ti(s);ΔH=-512 kJ/mol
(4)在上述产业链中,合成192 t甲醇理论上需额外补充H2 ( ) t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.关于下列各图的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27、(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为( )。
(2)图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式( ) 。
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l) △H= -483.6 kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H=+67.8 kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H=-92.0 kJ/mol
请计算NH3 (g)的燃烧热( )。
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s)
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是 ( )。
(2)在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是( )。
(3)淡水的出口为( )(填“a”、“b”或“c”)。
正确答案
Ⅰ、
(1) 10% (1分)
(2) NO2(g) + CO(g) = NO(g) + CO2(g) △H = -234KJ/mol(2分)
(3) 282.8kJ/mol(2分)
(4)D(2分)
Ⅱ、
(1)(1分)2Cl—-2e—=Cl2↑
(2)(2分)Mg(OH)2;Ca2++ OH—+HCO3—=CaCO3↓+H2O (2分)
(3)b(2分)
解析
解析已在路上飞奔,马上就到!
知识点
12. 关于下列各图的叙述正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.已知:① 2C(s) + O2(g) = 2CO(g) ΔH=-220 kJ·mol-1
② 氢气燃烧的能量变化示意图如下:
下列说法正确的是( )
正确答案
解析
A.由于1molC(s)反应生成物为CO时,释放的能量为110 kJ,所以完全燃烧生成当生成CO2时,释放的能量要大于为110 kJ,所以A错误;
B.破坏反应物中化学键要吸收能量,所以根据氢气和氧气的键能并结合化学方程式可知生成2mol水应该先要吸收436kJ×2+496kJ=1368kJ;而形成新化学键时要释放能量,因此根据键能可知生成2mol水应该释放462kJ×4=1848kJ,所以生成2mol水实际放出的热量是1848kJ-1368kJ=480kJ,所以H2(g) + 1/2O2(g) === H2O(g) ΔH=-240 kJ·mol-1,所以B错误;
C.根据反应2C(s) + O2(g) = 2CO(g) ΔH=-220 kJ·mol-1以及2H2O(g) === 2H2(g) + O2(g) ΔH=+480 kJ·mol-1,结合盖斯定律可知:2C(s) + 2H2O(g) === 2CO(g)+2H2(g) ΔH=+260 kJ·mol-1,所以C(s) + H2O(g) === CO(g)+H2(g) ΔH=+130 kJ·mol-1,故C正确;
D.由图中可以判断出欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量,所以D错
考查方向
化学键的键能与化学反应的能量关系以及盖斯定律的应用。
解题思路
A.1molC(s)完全燃烧生成物为CO2,释放的能量要大于110 kJ;
B.破坏反应物中化学键要吸收能量,所以根据氢气和氧气的键能并结合化学方程式可知生成2mol水应该先要吸收436kJ×2+496kJ=1368kJ;而形成新化学键时要释放能量,因此根据键能可知生成2mol水应该释放462kJ×4=1848kJ,所以生成2mol水实际放出的热量是1848kJ-1368kJ=480kJ。
C.根据反应2C(s) + O2(g) = 2CO(g) 以及H2(g) + 1/2O2(g) === H2O(g) ,结合盖斯定律进行计算;
D.由图中可以判断出欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量。
易错点
忽略反应物状态与化学反应能量的关系。
知识点
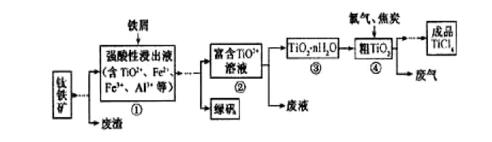
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe=3Fe2+
2TiO2+(无色) +Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O=TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_______范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+
(4)已知:TiO2 (s) +2 Cl2 (g)=TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=2CO(g) △H=-221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
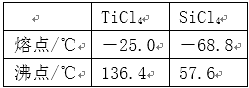
(6)依据右表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
正确答案
见解析。
解析
(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+”。
(2)形成TiO2·n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10- 7m(或1nm—100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe (OH)3+3H+
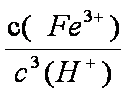
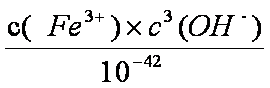

(4)涉及盖斯定律计算,比较常规,按要求写出方程式相加即可得出答案:
TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)右表信息可以看出,SiCl4,TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
知识点
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
正确答案
解析
略
知识点
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq) + OH—(aq) == F—(aq) + H2O(l) △H = - 67.7 kJ•mol-1
②H+ (aq) + OH—(aq) == H2O(l) △H = - 57.3 kJ•mol-1
在20 mL 0. 1 mol•L-1氢氟酸中加入V mL 0. 1 mol•L-1NaOH溶液。下列有关说法正确的是
正确答案
解析
本题考查盖斯定律的应用、酸碱中和反应及溶液中离子浓度大小的比较,旨在考查考生对所学生所学知识的整合及应用能力。。
根据盖斯定律,将①式减去②式经整理可得:
HF(aq) 
由反应①放热比反应②多,亦可判断氢氟酸的电离为放热,本题要求突破“弱电解质电离都是吸热”的思维定势。故A选项错误。
当V=20时,两者恰好完全反应生成NaF,溶液中存在质子守恒关系:
c(OH-) = c(HF)+c(H+)
质子守恒式有两种方法推得:
(1)直接推得:因F-水解结合H2O电离出的H+生成HF并提供与HF等量的OH—,且H2O本身电离出H+和OH—;
(2)由NaF溶液的电荷守恒式和物料守恒式求得:NaF溶液的电荷守恒式:
c(Na+) + c(H+) = c(F-) + c(OH-)
NaF溶液的物料守恒式:c(Na+) = c(HF) + c(F-)
消去2个式子中的c(Na+)可得出其质子守恒式 。
因F-水解,故溶液中存在:c(F-)<c(Na+) = 0.05 mol•L-1 ,故B选项正确,C选项错误。
D选项:溶液中离子浓度的大小取决于V的大小,离子浓度大小关系可能为c(F-)>c(H+)>c(Na+)>c(OH-)或c(F-)>c(Na+)>c(H+)>c(OH-)或c(Na+) = c(F-)>c(OH-) = c(H+)或c(Na+)>c(F-)>c(OH-)>c(H+),故D选项错误。
为了更清晰明确D选项的问题,不妨进行如下分析:
影响溶液中各离子浓度的因素有2个:(1)离子的物质的量;(2)溶液的体积。
根据这2个因素的影响,可绘制出下图:
根据上图,并结合离子的变化,可以得到下表离子浓度的大小比较:
知识点
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g),ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )
正确答案
解析
略
知识点
扫码查看完整答案与解析