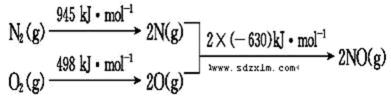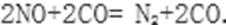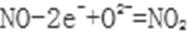- 化学反应原理
- 共2396题
height
正确答案
24.NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: ______________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: ______________________。
②随温度升高,该反应化学平衡常数的变化趋势是___________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: ______________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是______________________,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是___________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: ______________________。
正确答案
(1)3NO2+H2O=2HNO3+NO
(2)
②K值增大。
(3)
①
②Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)
①还原。
②
解析
解析已在路上飞奔,马上就到!
知识点
12.已知:可逆反应N2(g)+3H2(g
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为( )。
(2)某温度下,向4 L恒容密闭容器中通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积 分数均为
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是( ) (填“3.5× 106 Pa""4.0×106 Pa"或“5.0X 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是( )。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入a气体的电极是电池的( )(填“正”或“负”)极,其电极反应式为( )
②常温下,用此电池以惰性电极电解0.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为( )(忽略溶液的体积变化)。
正确答案
(1)
(2)1;33.3%
(3)
①
②高于
(4)
①负;
②13
解析
解析已在路上飞奔,马上就到!
知识点
29.烯烃通过臭氧化并经锌和水处理得到醛和酮。例如:
Ⅰ.已知丙醛的燃烧热为1815kJ/mol,丙酮的燃烧为1789 kJ/mol,试写出丙醛燃烧的热化学方程式 ( )。
Ⅱ.上述反应可用来推断烯烃的结构,一种链状单烯烃A(C8H16)通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E 。反应图示如下:
回答下列问题:
(1)B的相对分子质量是( );C→F的反应类型为( ),D中含有官能团的名称 ( ) 。
(2)D+F→G的化学方程式是:( )。
(3)A的结构简式为( ) 。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理得到一种产物,符合该条件的异构体的结构简式有 ( )种。
29.烯烃通过臭氧化并经锌和水处理得到醛和酮。例如:
Ⅰ.已知丙醛的燃烧热为1815kJ/mol,丙酮的燃烧为1789 kJ/mol,试写出丙醛燃烧的热化学方程式 。
Ⅱ.上述反应可用来推断烯烃的结构,一种链状单烯烃A(C8H16)通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E 。 反应图示如下:
回答下列问题:
(1)B的相对分子质量是 ;C→F的反应类型为 ,D中含有官能团的名称 。
(2)D+F→G的化学方程式是: 。
(3)A的结构简式为 。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理得到一种产物,符合该条件的异构体的结构简式有 种。
正确答案
23.下表所列是元素周期表部分短周期的主族元素
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3.X2.W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N204反应生成N2和水蒸气。

写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0 L恒容密闭容器中充入1.00 mol PCl5,反应

相同温度下,起始时向容器中充入1.00 mol PC15.0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.某学习小组模拟工业上由铝矾土(含Al203和少量的Si02及铁的氧化物)制备 金属铝的方法,设计了实验室用铝矾土制备金属铝的方案,主要流程如下图所示:
已知:
(1)为了加快铝矾土的酸溶速率,除了反应过程不断搅拌外,还可釆取的措施有_______(至少二条)。
(2)加入H202时,发生反应的离子方程式为 _______。要检验Fe2+是否反应完全应选择的试剂是_______。(供选试剂:KMn04溶液、KSCN溶液、NaOH溶液、H202溶液)。加入NaOH调节滤液A的pH在_______范围。
(3) 流程中有多次过滤,需制作一个简单的过滤器,所需的用品有_______
(4)电解Al2O3时阳极生成的02全部与石墨反应转化为C02和CO。相关反应的热化学 方程式如下:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是____。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式________。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有____(填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol· L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是____(填选项)。
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是:( )。
(6)已知:
请写出Fe3+发生水解反应的热化学方程式.______。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数K=( )。(用含KSP、KW的代数式表示)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则:
①工业上反应II在( ) 中进行(填设备名称),工业上反应III用于吸收E的试剂是( ) 。
②反应I的化学方程式是 ( )。

①A的电子式是( )。
②写出D和乙反应的离子方程 式:( ) 。
③25℃时,在右图装置中的小烧杯里先倒入50mL 0.50mol/L G的稀溶液,然后一次加入50mL 0.55 mol/L D的稀溶 液,经测定反应中放出的热量为1.4kJ,反应的热化学方程为:( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
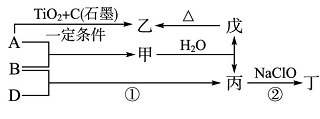
23.已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)戊与强碱反应的离子方程式:( )。
(2)NaClO的电子式为( )。
(3)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:( ) 。
(4)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1mol乙时放出536 kJ热量,其热化学方程式为:( )。
(5) 室温下,0.1mol•L-1氯化铵溶液pH=5.1。若室温下氨水的电离常数Kb=10-x,则x=( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式___________________。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为________。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是_______,图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是________。
②由图可得Fe(OH)2的溶度积的值为_________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g)
II:CO(g) + 2H2(g)
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:__________________________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用上图装置模拟上述过程:
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
正确答案
(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1
(2)
①0.03 mol•L-1•min-1
②2.25×10-4
(3)C、D
(4)
①Co2+—e-=Co3+
① 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
解析
解析已在路上飞奔,马上就到!
知识点
28.工业生产尿素过程中涉及的物质转化过程如下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为__________
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:_____________________
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
①若分别用



②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数__________(填“变大”“变小”或“不变”)。
③在

(4)



(5)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成
正确答案
(1)
(2)移走氨气,减小生成物的浓度,平衡右移,有利于氨的合成
(3)①< ②不变 ③66.7
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
27.硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①不反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2===□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③不分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
正确答案
(1)除去反应器中的水蒸气和空气;煤油;镊子 ;滤纸
(2)1




(3)过滤;蒸馏
(4)
解析
解析已在路上飞奔,马上就到!
知识点
20.甲醇是极为重要的有机化工原料,在化工、医药、轻工、纺织及运输等行业都有广泛的应用。可以用CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g)
II:CO(g) + 2H2(g)
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:______________________________。
(2)在压强为0.1MPa、温度为300℃条件下,使1molCO与2molH2在催化剂作用下在恒温恒容的容器中发生反应II生成甲醇,下列有关说法正确的是 (填字母序号)。
A.移走CH3OH,平衡正向移动,正反应速率加快
B.反应达平衡后,再加入1molCO与2molH2,CO转化率增大
C.混合气体的密度不变时,说明反应达到平衡
D.平衡后,将容器体积压缩至原来一半,平衡常数K增大
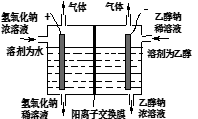
(3)某科研组设计见如图装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过)。电解时阳极产成的气体是 ,阴极发生的电极反应式为 。
(4)甲醇对水质会造成一定的污染,可利用Co2(SO4)3氧化除去甲醇,得到CoSO4和一种常见气体。请写出除去甲醇的离子方程式 。
正确答案
(1)CH4(g)+H2O(g) =CH3OH(g) +H2(g)△H=+77.0 kJ/mol
(2)B
(3)O2;CH3CH2OH+2e-=2CH3CH2O-+H2↑
(4)6Co3+ + CH3OH + H2O = CO2↑+ 6Co2+ + 6H+
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析