- 化学反应原理
- 共2396题
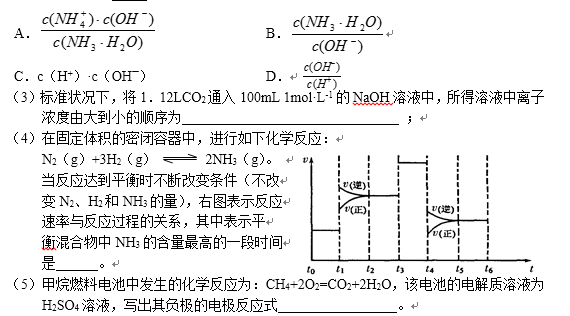
14.(10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式( ) 。
(2)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L-1的氨水,溶液中随着水量的增加而减小的是 ( )(填序号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15. 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应

达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
(第18-1、18-2题为《有机化学基础》模块题,第19-1、19-2题为《物质结构与性质》模块题,第20-1、20-2题为《化学与技术》模块题。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。
《有机化学基础》
18-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是 ( )
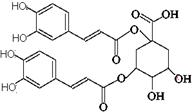
B.一定条件下能发生酯化反应和消去反应
C.发生水解反应,水解后生成两种物质
D.1mol洋蓟素最多可与11molNaOH反应
E.1mol洋蓟素最多可与5molBr2反应
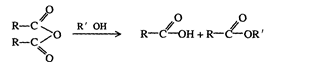
18-2.(14分)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:
已知:
合成路线:
上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应② ( ) 反应④ ( ) 。
(2)写出结构简式:Y ( ) F ( ) 。
(3)写出B+E→J的化学方程式 ( ) 。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式: ( ) 、 ( ) 。《物质结构与性质》19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
下列说法正确的是 ( )
A.NH3和H2O的中心原子都是SP3杂化
B.随着核电荷数的递增,同主族元素的单质熔点不断升高
C.苯和乙烷的蒸发时破坏的作用力是一样的
D.金刚石和石墨都属于原子晶体
E.在晶体中只要有阴离子就一定有阳离子19-2.(14分)
A、F原子的最外层电子数均等于其周期序数,F原子的电子
层数是A的3倍;B原子核外电子分处3个不同能级,且每个
能级上排布的电子数相同;A与C形成的最简单分子为三角锥
形;D原子p轨道上成对电子数等于未成对电子数;E原子核
外每个原子轨道上的电子都已成对,E电负性小于F。
⑴ 写出B的基态原子的核外电子排布式 ( ) 。
⑵ A、C形成的最简单分子极易溶于水,其主要原因是 ( ) ;与该最简单分子互为等电子体的阳离子为 ( ) 。
⑶ 比较E、F的第一电离能:E ( ) F(选填“>”或“<”=。
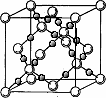
⑷ BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 ( ) 。
⑸光谱证实单质F与强碱性溶液反应有[F(OH)4]—生成,则[F(OH)4]—中存在 。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
《化学与技术》20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
为全面推动国际旅游岛建设,大力发展绿色产业,保护和改善自然环境,据此下列各项措施符合海南省发展方向的是: ( )
A.发展水电核电,充分利用太阳能、风能、潮汐能发电以减少火力发电带来的二氧化硫和二氧化碳排放问题
B.发展低碳经济、循环经济、积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
C.依托南海资源,大力发展石油化工产业,打破传统的产业结构
D.加速建设城际轻轨,发展改善城市公交系统,减少汽车尾气排放
E.推行垃圾分类,对未经分类的生活垃圾和工业垃圾使用填埋法处理20-2.(14分)
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水。
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,
它只允许 ( ) (填离子符号,下同)通过,
而不允许 ( ) 和气体通过。
电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙
及Ca2+、 Mg2+ 、Fe3+、 SO42-等杂质,因此必须精制。
精制时所用试剂为① NaOH ② Na2CO3 ③ BaCl2④ 盐酸,
这四种试剂的添加顺序为 ( ) (填序号)。
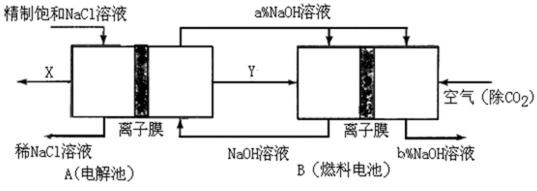
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
① 图中X、Y分别是 ( ) 、 ( ) (填化学式),分析比较图示中氢氧化钠
质量分数 a%与b%的大小 ( ) ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极: ( ) ; 负极: ( ) ;
③这样设计的主要节(电)能之处在于(写出2处) ( ) 、 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②, 横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.(9分)由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式( ),该反应的还原产物是( )。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
(1)电池中的左侧“电极”的电极名称是( )(填“正极”或“负极”)。
(2)放电过程中钠离子从( )(选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极FePO4+Li++e-===LiFePO4,负极Li-e-===Li+.
下列说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 
镍镉碱性充电电池在放电时,其
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为( ),其在充电时阳极反应为( );
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为( );
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的
主要原因可能是 ( );
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4( )mol。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.右图为一种原电池,下列有关说法正确的是( )

正确答案
解析
解析已在路上飞奔,马上就到!
知识点

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.结合右图判断,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
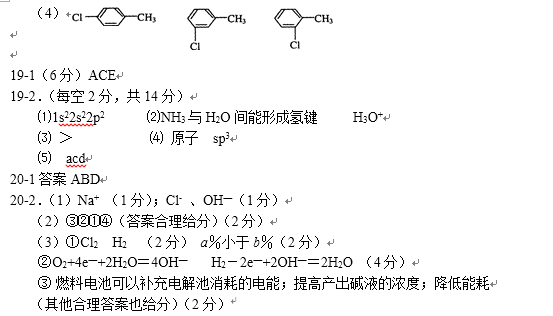
24.“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒。回答有关问题。
(1)“84”消毒液显碱性,原因是发生水解反应:ClO-+H2O
①该反应的平衡常数表达式K=( );25℃时某“84”消毒液pH为10,35℃时pH为11,则温度升高,K( )(填“增大”、“不变”或“减小”)。
②测定“84”消毒液的pH,应该选用( )。
A.干燥的pH试纸 B.用蒸馏水湿润的pH试纸 C.pH计(或酸度计)
(2)在烧杯中盛放25mL某浓度的“84”消毒液,在光照下对其消毒效果的变化进行探究,实验结果如图所示。
①a-b段导致消毒效果增大的主要反应是:( ) 。
②b-c段导致消毒效果减弱的主要反应是:( )。
(3)有一则报道称:有人在清洗卫生间时,因为把“84”消毒液和某清洁剂(含盐酸)混合使用,发生了中毒事故。原因是( )。
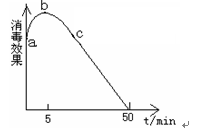
(4)利用图所示装置和试剂可以制得少量“84”消毒液。
①a电极的名称是( )。
②y电极的反应式为 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.aA、bB、cC、dD、eE、fF、 gG七种短周期元素,原子序数依次增大。已知部分元素的原子序数有如下关系:b + c = f。人类巳知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素;E、D、G组成的36电子的化合物N,是家用消毒剂的主要成分。请回答下列问题:
(1)消毒剂N的水溶液呈碱性,原因用离子方程式表示( )。
(2)元素E与D按原子个数比1:1形成的化合物M所含的化学键有( )(填化学键名称)。
(3)在A、B、D三种元素中选择两种或三种元素,组成两种可以发生反应的离子,写出该反应的离子方程式:( )
(4)已知在标准状况下,6g B单质完全燃烧和不完全燃烧分别放出Q1 和Q2 kJ 的热量,写出B单质与BO2反应的热化学方程式( )
(5)已知1 mol 化合物N与Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式( )
(6)常温下已知Ksp[F(OH)3]=1.3×10-33 ,若要使1.3mol·L-1 F3+ 离子开始生成F(OH)3沉淀, 应调节溶液的pH大于( )
(7)用惰性电极电解化合物FG3的水溶液,写出该电解池的总化学反应方程式:( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.2010年在上海举办的世博会将主打环保牌,20辆氢燃料电池公交车、300辆氢燃料电池出租车将投入运行,它们以氢气为能源,实现了真正的零污染。氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
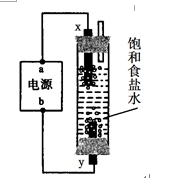
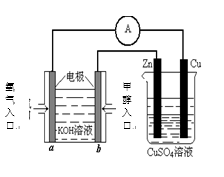
23.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)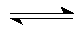
(2)若在230℃时,平衡常数K=1。若其它条件不变,
将温度升高到500℃时,达到平衡时,K ( ) 1 。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的( )倍。
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为( )极;
①写出b极的电极反应式
②当铜片的质量变化为12.8 g时,a极上消耗的 O2
在标准状况下的体积为( ) L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析