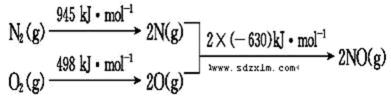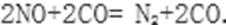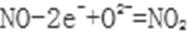- 化学反应原理
- 共2396题
12.据报道,锌-空气电池将会成为21世纪理想动力源。在碱性溶液中该电池总反应可表示为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: ______________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: ______________________。
②随温度升高,该反应化学平衡常数的变化趋势是___________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: ______________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是______________________,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是___________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: ______________________。
正确答案
(1)3NO2+H2O=2HNO3+NO
(2)
②K值增大。
(3)
①
②Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)
①还原。
②
解析
解析已在路上飞奔,马上就到!
知识点
10.水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点。以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe-= NaLixV3O8,则下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.某小组在研究前1 8 号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成图①所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P 点代表氢元素。
(1)K 元素在常规周期表中的位置__________(填周期和族)。
(2)写出M 与Z 两种元素形成的化合物的电子式_________。
(3)下列说法正确的是________。
a.Y 元素对应的氢化物比K 元素对应的氢化物更稳定
b.虚线相连的元素处于同一族
c.K、L、X 三种元素的离子半径大小顺序是X3->L+>K2-
d.由K、L 两种元素组成化合物中可能含有非极性共价键
(4)图②装置可以模拟钢铁的腐蚀碳棒一极的电极反应式是_______。若在
图②溶液中滴加少量酚酞溶液并进行电解,发现Fe 电极附近溶液变红,清写出
碳棒一极的电极反应式________。牺牲阳极的阴极保护法利用
的原理是_______(填“电解池”或“原电池”)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为( );
(4)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式( );
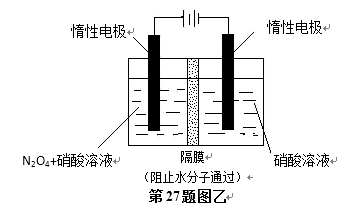
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图乙所示,N2O5在电解池的 ( )(填“阳极”或“阴极”)区生成,其电极反应式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(15分)运用化学反应原理分析解答以下问题
(1)已知:
① CO(g)+2H2(g)
② 2CH3OH(g)
③ CO(g)+H2O(g)
且三个反应的平衡常数依次为K1、 K2 K3
则反应 3CO(g)+3H2(g)
化学平衡常数K = ( ) (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1∶2的CO和.H2 气体通入体积一定的密闭容器中发生反应
3CO(g)+3H2(g)
a.体系压强保持不变 b.混合气体密度保持不变
c.CO和H2的物质的量保持不变 d.CO的消耗速率等于CO2的生成速率
(3)氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为Mn02)生产髙锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04), 该反应的化学方程式是______________
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2Mn04)溶液,在_______ (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2) 某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2Mn04.Mn02及Pb.Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
③轧钢废酸中Fe2+的作用是______________o
④操作I.操作Ⅱ.操作Ⅲ的名称是_______。
⑤溶液C中除含有Ca2+.Mn2+.H+外,还含有的阳离子是_______
⑥若固体C中不含CaCO3,则溶液D中
(已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为( )。
(2)将1.0molCH4和2.0molH2O(g)通人容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图一。

图一 图二
①假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 ( );
②100℃时反应I的平衡常数为( )。
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是( )(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有两种:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.近日,卫生部公布了食盐碘含量的标准,规定每千克碘含量不超30毫克,新标准明年3月15日起实施。氯化钠既是是一种重要的生活必需品,也是重要的化工原料。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次 增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,另外三种是固体。
请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为( ),其分子属于( )(选填“极性”或“非极性”)分子。
D与C形成的化合物D2C2可与Y反应生成单质C,写出该反应的化学方程式并标明电子转移的方向和数目: ( ) 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E的化 学反应方程式: ( ) 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8 g W气体(已知
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通人A的单质气体,N极通入C的单质气体,则M极的电极反应式为 ( ) 。
(5)在10 L的密闭容器中,通入2 mol的FC2气体和3 mol的C气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol/L,则平衡时FC2的转化率为 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___________(填化学式);
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___ ____(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式_________________ ___________________;
②分析产品室可得到H3PO2的原因__________________ _________________;
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是 ________________ 。
正确答案
(1)H3PO2
(3)2P4+3Ba(OH)2+6H2O=2PH3↑+3Ba(H2PO2)2
(4)①2H2O-4e-=4H++O2↑或4OH--4e-=2H2O+O2.
②由于阳极室OH-放电,造成H+浓度增大,通过阳膜扩散进入产品室,而原料室中的H2PO2-可以通过阴膜进入产品室,二者反应生成H3PO2.
③H3PO4或PO43-。由于H3PO2具有还原性,电解时就会有H3PO2在阳极放电而被氧化生成H3PO4。
解析
解析已在路上飞奔,马上就到!
知识点
8. 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色),回答下列问题:
(1)电解过程中电极附近溶液颜色变化正确的是______(填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应:___________;
(3)写出B管中发生的反应:_______;
(4)检验a管中气体的方法是___________;
(5)检验b管中气体的方法是_______;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是________。
正确答案
(1)①④
(2)2H++2e-

(3)4OH--4e-
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,木条复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
解析
解析已在路上飞奔,马上就到!
知识点
9.2013年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:_____________________。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),
反应原理为:NO(g) +NO2(g)+2NH3(g)
① 该反应的△S_____0,△H_____0(填“>”.“=”或 “<”)。
② 对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=___________。
③以下说法正确的是_______。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃ 和450℃ 左右脱氮
(4)NO2.O2和熔融NaNO3可制作燃料电池,其原理见右图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为________________________。
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO.NO2体积比为1:1)的质量为__________g。
正确答案
(1) b d
(2)CH4(g)+N2O4(g) ==N2(g) +2H2O(l) + CO2(g) △H= —898.1kJ/mol
(3)
① > <
②KP=
③ C
(4)NO2+NO3— —e-=N2O5
(5)76g
解析
解析已在路上飞奔,马上就到!
知识点
31.镍、钴、铈、铬虽然不是
(1)二氧化铈(CeO2)是一种重要的稀土氧化物,在平板电
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:
Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为_____________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的______________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
正确答案
(1)还原;2mol
解析
解析已在路上飞奔,马上就到!
知识点
27.硼元素在自然界主要以硼酸、硼酸盐和硼硅酸盐存在。请回答下列问题:
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对分子质量为 。
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7·10H2O)制备硼酸晶体的流程如下:
不同温度下硼酸的溶解度见下表:
①写出硼砂溶液和稀硫酸反应的离子方程式 。
②上述流程中获得粗硼酸晶体的操作Ⅰ为 、过滤;进一步将粗硼酸晶体提纯的方法是 。
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 。
(3)硼酸在加热过程中发生分解的失重曲线如下图所示:
①硼酸从开始加热到107℃时,发生反应的化学方程式为 。
②硼酸加热到160℃得到的固体的化学式 。(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂。在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2 + 2H2O = 2O2↑ + NaBH4,则阴极反应式为 。
正确答案
(1)
(2)
①5H2O + B4O72- + 2H+ = 4H3BO3
②降温结晶(冷却热饱和溶液) 重结晶
③10-9.2
(3)H3BO3 == HBO2 + H2O H2B4O7
(4) BO2- + 6H2O + 8e- = BH4- + 8OH-
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析