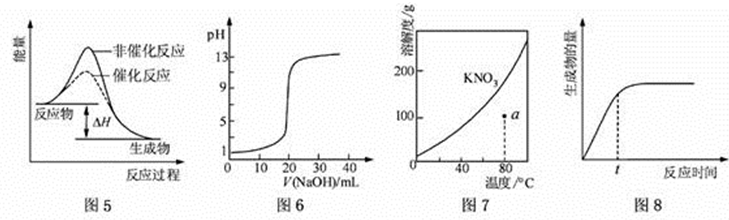
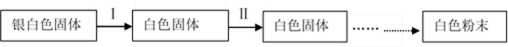- 吸热反应和放热反应
- 共25题
下列图示与对应的叙述相符的是
正确答案
解析
本题考查学生对化学反应热效应、酸碱中和滴定、溶解度曲线、平衡转化率等角度的理解能力。是基本理论内容的综合。高三复习要多注重这一方面的能力训练。
A.图5表示反应物总能量大于生成物总能量,是放热反应。
B.图6中当NaOH与CH3COOH等物质的反应时,溶液因盐类水解而呈碱性,突跃该曲线前。
C.图7通过a作一条辅助线,与KNO3的溶解度曲线有一交点在a点之上,说明a点溶液是不饱和溶液。
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时曲线并没有达到平衡,所以反应物的转化率并不是最大。
知识点
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
正确答案
解析
由反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)可以看出,A+B →C(△H <0)是放热反应,A和B 的能量之和C,由① A+B→X (△H >0)可知这步反应是吸热反应,X→C(△H <0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X 的能量大于C,答案:D。
知识点
下列有关说法正确的是
正确答案
解析
本题是化学反应与热效应、电化学等的简单综合题,着力考查学生对熵变、焓变,水解反应、原电池电解池、化学反应速率的影响因素等方面的能力。
A分解反应一般是常识吸热反应,熵变、焓变都大于零,仅在高温下自发。内容来源于《选修四》P34-P36中化学方向的判断。
B铁比铜活泼,组成的原电池中铁为负极,更易被氧化。
C据平衡移动原理,升高温度平衡向逆反应方向移动,平衡转化率减小。
D水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应,越热越电离,水的离子积常数Kw随着温度的升高而增大。
知识点
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
正确答案
解析
略
知识点
2SO2(g)+ O2 (g) 
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3•H2O)= 2[c()+ c()+ c(H2SO3)]
b. c()+ c(H+)= c()+ c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
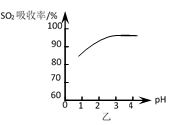
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。
图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
正确答案
见解析。
解析
(1)放热 0.08
(2)①ac
i. 
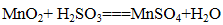
ii. 2SO2+ 2H2O +O2 === 2H2SO4
不利于 溶液中存在 SO2+ H2O 

知识点
下列与化学反应能量变化相关的叙述正确的是
正确答案
解析
生成物的总能量低于反应物的总能量,是放热反应,若是吸热反应则相反,故A错;反应速率与反应时放热反应还是吸热反应没有必然的联系,故B错;C是盖斯定律的重要应用,正确;根据△H=生成物的焓-反应物的焓,可知,焓变与反应条件无关,故D错。
知识点
在2 L的密闭容器中进行如下反应: CO(g)+H2O(g)
下列说法正确的是
正确答案
解析
略
知识点
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) 
请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5L,2min后达到平衡,测得固体的质量减少了4.80g,则H2的平均反应速率___________;该反应的化学平衡常数表达式K=___________________________。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为______;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_______(填“吸热”或“放热”)。
(3).一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A. 混合气体的总压强保持不变 B. v正(H2O)=v正(H2)
C. 混合气体的密度保持不变 D. 混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
正确答案
(1)0.3mol/(L •min)
(2)60% 吸热
(3)CD
(4)AB
解析
略
知识点
研究减少有毒气体的排放对改善环境消除雾霾有十分重要的意义。
(1)①科学家设想将温室气体CO2转化为有机物来有效实现碳循环
以上反应中不仅体现了绿色化学思想,且原子利用率最高的是________。
②工业上常用NH3和(NH4)2CO3通过下列反应捕获CO2,以降低温室气体CO2的排放
则△Ha与△Hb、△Hc之间的关系是:△Ha=________。
(2)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)= 5CO2(g)+I2(s) △H。 不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4molCO,测得CO2的体积分数

①该反应属于________反应(填“放热”或“吸热”)。
②从反应开始至a点时的反应速率为v(CO)=________,b点时化学平衡常数Kb=________。
③下列说法不正确的是________(填字母序号)。
A. 容器内气体密度不变,表明反应达到平衡状态
B. 两种温度下,c点时体系中混合气体的压强相等
C. 增大d点的体系压强,CO的转化率不变
D. b点和d点的化学平衡常数:Kb<Kd
(3)工业上,用Na2SO3溶液作为吸收液吸收烟气中的SO2,吸收液吸收SO2的过程中,室温时溶液中的c(H+)随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断Na2SO3溶液显 性,HSO3-的电离常数为________。
②当吸收液呈中性时,溶液中离子浓度大小关系是________。
正确答案
(1)①b;②2△Hc-△Hb
(2)①放热;②1.6 mol·L-1·min-1;1024 或者45;③bd
(3)①碱;6.3×10-8 mol·L-1;②c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
解析
略。
知识点
切开的金属Na暴露在空气中,其变化过程如下:
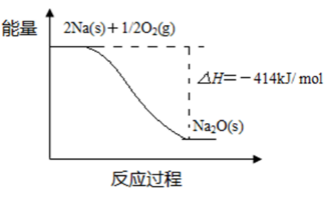
(1)反应Ⅰ的反应过程与能量变化的关系如下:
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
a.升高温度,溶液的pH降低
b.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
c.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
d.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na 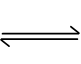
正确答案
见解析。
解析
(1)①放热 反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol
(2)
(3)b c
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
② NiCl2+ 2Na+ + 2e-= Ni +2 NaCl
知识点
扫码查看完整答案与解析