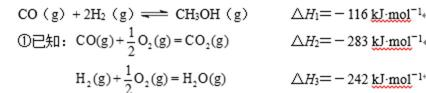- 反应热和焓变
- 共30题
SF6是一种优良的绝缘气体,分子结构中只存在S—F键,已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ.则S(s)+3F2(g)=SF6(g)的反应热ΔH为
正确答案
解析
本题考查化学热计算,化学反应的实质是旧键的断裂和新键的生成,旧键的断裂吸收热量,新键的生成放出热量,两个热量变化的总体效应即为反应的热效应,S(s)+3F2(g)===SF6(g)的反应过程中旧键断裂吸收的热量为280 kJ+160 kJ×3=760 kJ,新键生成放出的热量为330 kJ×6=1980 kJ,反应放出1220 kJ的热量,ΔH=-1220 kJ/mol.
知识点
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
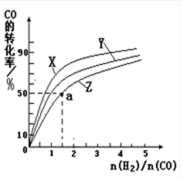
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) 
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 。
正确答案
(1)3 2 8 H2SO4 3 2 2 8 (3分,填上H2SO41分,配平2分)
K2Cr2O7(1分),CO2(1分)
(2)①CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g) △H=-651kJ·mol-1(3分)
②ⅰ)270℃(2分) ⅱ) 4 L2 /mol2(2分,没单位不扣分)
③增大H2的浓度(2分);增大了0.1 mol•L-1(2分)
解析
略
知识点
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下:
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行:
由乙苯制取苯乙烯反应的
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a、正、逆反应速率的比值恒定 b、c(CO2)=c(CO)
c、混合气体的密度不变 d、CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填
正确答案编号)
a、大于0.5mol/L b、小于0.5mol/L
c、等于0.5mol/L d、不确定
(3)在温度为T2时的恒容器中,乙苯、CO2的起始浓度分别为2.0mol/L和3.0mol/L,设反应平衡后总压强为P、起始压强为

(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
正确答案
(1)+158.8KJ/mol
(2)
(3)
(4)
解析
略
知识点
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
正确答案
解析
本题属于化学反应与能量的考查范畴,虽然《2012年江苏考试说明》中没有提及“活化能”这一概念,但《选修四》课本第3页的绪言中就有这些内容,新课程标准中也有“活化能”这一概念。看来高三复习一定注意要抓课本、抓基础,抓《考试说明》的同时,适当兼顾新课程标准,不能急功近利、顾此失彼。
知识点
工业生产水煤气的反应为:C(s)+H2O(g)→CO(g)+H2(g)-131.4 kJ
下列判断正确的是
正确答案
解析
本题考查热化学知识,意在考查考生对概念的理解。由题中信息知合成水煤气反应为吸热反应,故可判知知反应物总能量小于生成物总能量,同时知生成1molH2时需吸收131.4KJ的热量,故A项错、C项正确、D项错;B项中H2O为液态,故B项错。
知识点
CO(g)+H2O(g)
正确答案
解析
催化剂虽然改变了反应途径,但是△H只取决于反应物、生成物的状态,△H不变,A错;这是一个反应前后气体物质的量不变的反应,改变压强,平衡不发生移动,反应放出的热量也不变,B正确;该反应是放热反应,升高温度,平衡左移,反应放出的热量减小,C错;若在原电池中进行,反应不放出热量,而是转换为电能,D错。
知识点
下列说法正确的是
正确答案
解析
没有标准状况的条件,不能确定11.2L的O2就是0.5mol,A项错误;温度越高纯净水的PH越低,B项错误。盐酸和醋酸都是一元酸,中和一元酸所需的氢氧化钠的物质的量都相等,C正确;△H 与化学计量数有关,D项错误。
知识点
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g),ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )
正确答案
解析
略
知识点
已知
则表中a为
正确答案
解析
本题考查盖斯定律的计算。由已知得:Br2(l)=Br2(g) △H=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);△H= -102KJ/mol。436+a-2×369=-102;a=200KJ,D项正确。
知识点
关于下列四个图象的说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析