- 吸热反应和放热反应
- 共25题
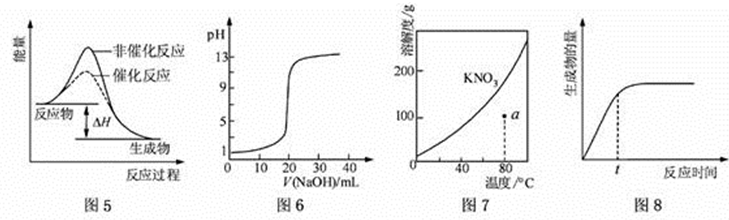
下列图示与对应的叙述相符的是
正确答案
解析
本题考查学生对化学反应热效应、酸碱中和滴定、溶解度曲线、平衡转化率等角度的理解能力。是基本理论内容的综合。高三复习要多注重这一方面的能力训练。
A.图5表示反应物总能量大于生成物总能量,是放热反应。
B.图6中当NaOH与CH3COOH等物质的反应时,溶液因盐类水解而呈碱性,突跃该曲线前。
C.图7通过a作一条辅助线,与KNO3的溶解度曲线有一交点在a点之上,说明a点溶液是不饱和溶液。
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时曲线并没有达到平衡,所以反应物的转化率并不是最大。
知识点
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
正确答案
解析
由反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)可以看出,A+B →C(△H <0)是放热反应,A和B 的能量之和C,由① A+B→X (△H >0)可知这步反应是吸热反应,X→C(△H <0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X 的能量大于C,答案:D。
知识点
下列有关说法正确的是
正确答案
解析
本题是化学反应与热效应、电化学等的简单综合题,着力考查学生对熵变、焓变,水解反应、原电池电解池、化学反应速率的影响因素等方面的能力。
A分解反应一般是常识吸热反应,熵变、焓变都大于零,仅在高温下自发。内容来源于《选修四》P34-P36中化学方向的判断。
B铁比铜活泼,组成的原电池中铁为负极,更易被氧化。
C据平衡移动原理,升高温度平衡向逆反应方向移动,平衡转化率减小。
D水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应,越热越电离,水的离子积常数Kw随着温度的升高而增大。
知识点
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
正确答案
解析
略
知识点
下列与化学反应能量变化相关的叙述正确的是
正确答案
解析
生成物的总能量低于反应物的总能量,是放热反应,若是吸热反应则相反,故A错;反应速率与反应时放热反应还是吸热反应没有必然的联系,故B错;C是盖斯定律的重要应用,正确;根据△H=生成物的焓-反应物的焓,可知,焓变与反应条件无关,故D错。
知识点
扫码查看完整答案与解析