- 卤族与氮族及其应用
- 共501题
6.将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是
正确答案
解析
A.将一定量的SO2通入FeCl3溶液中,加入NaOH溶液有红褐色沉淀生成氢氧化铁沉淀,过程中没有化合价变化,不是氧化还原反应,故A错误;
B.加入Ba(NO3)2溶液,有白色沉淀,硝酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,硫酸根与钡离子反应生成硫酸钡沉淀,即使二氧化硫与三价铁离子不发生氧化还原反应,也可产生白色沉淀,所以不能证明SO2与FeCl3溶液发生氧化还原反应,故B错误;
C.加入酸性KMnO4溶液,紫色退去,因为二氧化硫具有还原性能够还原酸性高锰酸钾,即使二氧化硫与三价铁离子不发生氧化还原反应,也可使其溶液褪色,所以不能证明SO2与FeCl3溶液发生氧化还原反应,故C错误;
D.亚铁离子加入K3[Fe(CN)6](铁氰化钾)溶液生成Fe3[Fe(CN)6]2↓(蓝色沉淀),则可证明溶液中存在二价铁离子,说明SO2与FeCl3溶液发生氧化还原反应,故D正确;
考查方向
解题思路
SO2与FeCl3溶液发生氧化还原反应则三价铁离子反应生成二价铁,过程中有化合价变化,据此判断解答
易错点
二氧化硫的性质是解题关键,注意二价铁离子的检验
知识点
4.下列说法正确的是()
正确答案
解析
A.液氨汽化时要吸收大量的热,使温度降低,可用作制冷剂,故A正确;B.常温下能用铝制容器盛放浓硝酸和浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应,故B错误;C.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起消毒杀菌的作用,故C错误.D.能置换出氧化铁中的铁,发生铝热反应,可以用来焊接钢轨,钢铁工业炼铁是利用还原法得到,一氧化碳还原氧化铁得到金属铁,故D错误;
故选A
考查方向
解题思路
A.液氨汽化时要吸收大量的热,使温度降低;B.常温下能用铝制容器盛放浓硝酸和浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应;C.明矾可用于净水,是因为明矾溶于水生成胶状物可吸附悬浮于水中的杂质;D.铝能置换出氧化铁中的铁,发生铝热反应,钢铁工业炼铁是利用还原法得到,一氧化碳还原氧化铁得到金属铁;
易错点
化学反应原理及化学方程式掌握不熟练
知识点
13.下列设计的实验方案能达到实验目的是()
正确答案
解析
A.新制Cu(OH)2悬浊液常用来检验醛基,应加碘水看是否变蓝,故A错误; B.碳酸钠能除掉氯化钙,过量的碳酸钠可用盐酸除去,故B正确;C.试管中先加入无水乙醇,再依次加入一定量浓硫酸、适量冰醋酸,然后加热制取乙酸乙酯,最后用饱和碳酸钠吸收,故C错误;D.炭与浓硫酸反应生成二氧化硫,同样能生成白色沉淀,故D错误.
故选B
考查方向
解题思路
A.新制Cu(OH)2悬浊液常用来检验醛基; B.碳酸钠能除掉氯化钙;C.浓硫酸在乙醇之后加入;D.炭与浓硫酸反应生成二氧化硫.
易错点
忽略实验步骤的先后顺序,干扰气体的排除
知识点
15.一定温度下,有两个体积均为

正确答案
解析
A.图象分析可知,CO(g)+2H2(g)⇌CH3OH(g),反应中CO转化率随温度升高减小,说明升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0,故A错误;B.依据化学平衡三行计算列式计算M点平衡浓度,CO转化率为60%,
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.6 1.2 0.6
平衡量(mol/L) 0.4 0.8 0.6
计算平衡常数K=c(CH3OH)/c(CO)c(H2)2=2.34,平衡常数随温度变化,M、N点温度相同化学平衡常数相同,故B错误;C.L、M两点是不同温度下的平衡,压强和气体物质的量成正比,CO转化率为60%,
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) 0.6 1.2 0.6
平衡量(mol) 0.4 0.8 0.6
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol) 2 4 0
变化量(mol) 1.2 2.4 1.2
平衡量(mol) 0.8 1.6 1.2
所以L、M两点容器内压强之比等于气体物质的量之比=(0.4+0.8+0.6):( 0.8+1.6+1.2)=1.8:3.6=1:2,P(M)=2P(L),但温度升高,M点压强增大,P(M)>2P(L),故C正确;
D.N点平衡体系中再加入1 mol CH3OH,相当于Ⅰ中再加入1molmol CO和2 mol H2,最后达到平衡状态和向Ⅱ中加入2 mol CO和4 mol H2的平衡状态相同,甲醇最后平衡状态为1.2mol,CO转化率60%,则相当于逆向进行甲醇分解率为40%,加入1mol甲醇增大压强平衡正向进行,则分解率小于40%,分解的甲醇小于0.4 mol,故D正确;
故选CD
考查方向
解题思路
A.CO转化率随温度升高减小,说明升温平衡逆向进行逆反应为吸热反应,正反应为放热反应;B.依据化学平衡三行计算列式计算M点平衡浓度,计算平衡常数K=c(CH3OH)/c(CO)c(H2)2
,M、N点化学平衡常数相同;C.L、M两点是不同温度下的平衡,压强和气体物质的量成正比,结合转化率计算平衡状态下气体物质的量比较;D.N点平衡体系中再加入1 mol CH3OH,相当于再加入1molmol CO和2 mol H2,最后达到平衡状态和向Ⅱ中加入2 mol CO和4 mol H2的平衡状态相同,据此计算.
易错点
化学平衡计算.
知识点
某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铭酸钾(K2Cr2O7)的流程如下:
已知:2CrO42-+2H+
25.上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是 。
26.酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH值的范围是 。
已知:Al(OH)3(s)
27.酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是 。
28.称取重铬酸钾试样2.40g配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6 min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00 mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
正确答案
33.6
解析
若将1mol Cr2O3转化成Na2CrO4,Cr2O3~2Na2CrO4~6e-,O2~4e-,
得到2Cr2O3~3O2~12e-,
2 3
1mol 1.5mol
消耗标准状况下氧气的体积=1.5mol×22.4L/mol=33.6L,
故答案为:33.6
考查方向
解题思路
流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾。
若将1mol Cr2O3转化成Na2CrO4,消耗氧气的体积依据电子守恒计算。
易错点
物质的分离提纯和鉴别
正确答案
5~8
解析
依据电离平衡常数和溶度积常数计算所需溶液的PH范围,
Al(OH)3(s)⇌H++AlO2-+H2O的K=c(AlO2-)×c(H+)=1×10-14,c(H+)=10-8mol/L,溶液PH=8,
Kap[Al(OH)3]=c(Al3+)×c3(OH-)=1×10-33 ,c(OH-)=10-9mol/L,c(H+)=10-5mol/L,溶液PH=5,
酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol•L-1,需调节溶液pH值的范围是5~8,
故答案为:5~8
考查方向
解题思路
流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾。
依据电离平衡常数和溶度积常数计算所需溶液的PH范围。
易错点
物质的分离提纯和鉴别
正确答案
K2Cr2O7 溶解度小于Na2Cr2O7
解析
操作中加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,K2Cr2O7 溶解度小于Na2Cr2O,利用复分解反应,可得到重铬酸钾。
故答案为:K2Cr2O7 溶解度小于Na2Cr2O7
考查方向
解题思路
流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾。
操作中加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大。
易错点
物质的分离提纯和鉴别
正确答案
依据反应的定量关系为:
K2Cr2O7~3I2~6Na2S2O3
1 6
0.24mol•L-1 ×0.020L n
n=0.0008mol,
称取重铬酸钾试样2.40g配成250mL溶液中重铬酸钾质量,
m(K2Cr2O7)=0.0008mol×294g/mol×
产品中重铬酸钾的质量分数=
答:产品中重铬酸钾的质量分数=
解析
称取重铬酸钾试样2.40g配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,反应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,然后加入适量水和数滴淀粉指示剂,用0.24mol•L-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL,
依据反应的定量关系为:
K2Cr2O7~3I2~6Na2S2O3
1 6
0.24mol•L-1 ×0.020L n
n=0.0008mol,
称取重铬酸钾试样2.40g配成250mL溶液中重铬酸钾质量,
m(K2Cr2O7)=0.0008mol×294g/mol×
产品中重铬酸钾的质量分数=
答:产品中重铬酸钾的质量分数=
考查方向
解题思路
流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾。
依据反应过程得到反应的关系式K2Cr2O7~3I2~6Na2S2O3计算产品中重铬酸钾的质量分数。
易错点
物质的分离提纯和鉴别
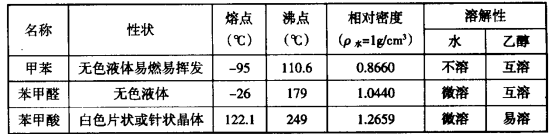
甲苯(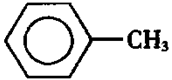
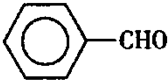
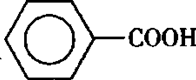
注:甲苯、苯甲醛、苯甲酸三者互溶。
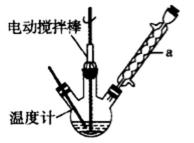
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和
2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧
化氢,在此温度下搅拌反应3小时。
16.装置a的名称是_________,主要作用是___________。
三颈瓶中发生反应的化学方程式为_________________,
此反应的原子利用率理论上可达______________。
17.经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________。
18.反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
19.实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯 甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加人盐酸调节pH=2
d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000moL/KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。下列情况会使测定结果偏低的是__________(填字母)。
a.滴定时俯视读取耗碱量
b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容
d.将酚酞指示剂换为甲基橙溶液
正确答案
球形冷凝管 冷凝回流,防止甲苯的挥发而降低产品产率
解析
因反应需持续加热,又为防有机物挥发,形球形冷凝管起冷凝回流,防止甲苯的挥发而降低产品产率。因为是用甲苯制苯甲醛,所以需用H2O2作氧化剂在催化剂作用下将其氧化,故化学方程式为: 
考查方向
有机化学实验与原理
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
正确答案
H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量
解析
因为H2O2热不稳定性,受热易发生分解,因此随温度升高时,分解率增大,产率随之降低。
考查方向
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
正确答案
过滤 蒸馏
解析
反应完毕后,反应体系中有除苯甲醛外还含有固体催化剂、醋酸、甲苯等,先进行过滤,再利用各组分的沸点不同,进行蒸馏分离。
考查方向
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
正确答案
①dacb ②87.84﹪ ad
解析
①将苯甲醛中混有的苯甲酸分离,可以先在混合体系中加入碳酸氢钠,将苯甲酸转化成可溶于水的盐,再进行分液,在水相中加入酸调节溶液PH重新制得苯甲酸,因苯甲酸在水中溶解度不大,大部分结晶析出,再过滤分离。
②滴定过程中苯甲酸与KOH按1:1反应:滴定过程中消耗n(KOH)=1.8

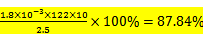
考查方向
解题思路
认真审题,充分把握题干上的信息,理清实验的操作及原理。
易错点
滴定误差分析、化学计算
7.下列指定反应的离子方程式正确的是()
正确答案
解析
A.正确;B.Na2SiO3是强电解质,在书写离子方程式的时候应拆开,错误;C.此时为AgCl悬浊液,悬浊液在离子方程式不能拆开,错误;D.Al3+只有在强碱中才生成AlO2-,此离子方程式为Al3++3NH3.H2O==Al(OH)3↓ +3NH4+,错误。
考查方向
解题思路
注重物质在离子方程式改写问题
易错点
反应原理理解不清晰,物质在离子方程式改写
知识点
14.已知:乙二酸(H2C2O4)是二元弱酸。向10 mL 0.1 mol·L-1 Na2C2O4溶液中逐滴加入a mL 0.1 mol·L-1盐酸(混合前后溶液体积变化可忽略
正确答案
解析
A.当a=5时反应得到等物质的量浓度的Na2C2O4溶液、NaHC2O4溶液、NaCl溶液的混合溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(Cl-)+2c(C2O42-),c(H2C2O4)≠c(HC2O4-)+c(Cl-),故A错误;B.当a=10时反应得到NaHC2O4溶液、NaCl溶液的混合溶液,溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(Cl-)+2c(C2O42-),物料守恒2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-)=c(Na+),带入计算得到c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B正确;C.当a=15时反应得到H2C2O4溶液、NaHC2O4溶液、NaCl溶液的混合溶液,溶液中存在物料守恒,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04mol•L-1,故C正确;D.当a=20时反应得到H2C2O4溶液、NaCl溶液的混合溶液,且氯化钠是草酸的2倍,草酸是二元弱酸分步电离c(Na+)>c(H+),故D错误。
故选BC
考查方向
解题思路
A.当a=5mL时,溶液中溶质为等物质的量浓度的Na2C2O4、NaCl、NaHC2O4,溶液中存在电荷守恒,根据电荷守恒判断;B.当a=10mL时,二者恰好完全反应生成等物质的量浓度的NaHC2O4、NaCl,溶液中存在电荷守恒、物料守恒,根据电荷守恒和物料守恒判断;C.当a=15时,反应得到H2C2O4溶液、NaHC2O4溶液、NaCl溶液的混合溶液,溶液中存在物料守恒;D.当a=20时,反应得到H2C2O4、NaCl的混合溶液,且氯化钠浓度是草酸的2倍.
易错点
计算错误
知识点
氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:

16.废铁在反应前常用热的纯碱溶液清洗表面油
17.氧化过程生成氧化铁黄的化学方程式是 。
18.检验洗涤是否完全的方法是 。
19.色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为 -0.5 ~ 0.5。
①氧化过程若温度太高,会导致产品颜色偏红,可能含有的杂质是 。
②氧化过程溶液pH对产率、色光度的影响如右图所示,氧化时应控制pH的合理范围是 ,pH过小导致产率较低的可能原因是 。
正确答案
CO32-+H2O⇌HCO3-+OH-
解析
过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄.
废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解,易于洗涤,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是:CO32-+H2O⇌HCO3-+OH-,
故答案为:CO32-+H2O⇌HCO3-+OH-
考查方向
解题思路
过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄。
废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解。
易错点
化学实验基本操作步骤
正确答案
4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O
解析
流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,同时生成硫酸钠和水,结合原子守恒和电子守恒配平书写化学方程式为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O,
故答案为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O
考查方向
解题思路
流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,结合原子守恒和电子守恒配平书写化学方程式。
易错点
化学实验基本操作步骤
正确答案
取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净。
解析
检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净,检验洗涤是否完全的方法是,取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净。
故答案为:取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净。
考查方向
解题思路
检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净。
易错点
化学实验基本操作步骤
正确答案
①Fe2O3或Fe(OH)3
②3.5~4.0 PH过低导致氧化铁黄部分溶于酸
解析
①氧化过程若温度太高,会导致产品颜色偏红,依据铁的化合物中呈红色的物质为氧化铁、氢氧化铁,可能含有的杂质是Fe2O3或Fe(OH)3
故答案为:Fe2O3或Fe(OH)3
②氧化时应控制pH的合理范围是保证产率最高,此时的PH范围依据图象分析可知为:3.5~4.0,pH过小导致产率较低是酸性增强,氧化铁黄会溶解于酸中。
故答案为:3.5~4.0,PH过低导致氧化铁黄部分溶于酸
考查方向
解题思路
①氧化过程若温度太高,会导致产品颜色偏红,依据铁的化合物中 呈红色的物质分析;
②氧化时应控制pH的合理范围是保证产率最高,pH过小导致产率较低是酸性增强,氧化铁黄会溶解于酸中。
易错点
化学实验基本操作步骤
11.下列根据实验操作和现象所得出的结论正确的是( )
正确答案
A
解析
A.胶体具有丁达尔性质;
B.将FeSO4高温强热,可生成二氧化硫和三氧化硫气体,二氧化硫与氯化钡不反应,得到的沉淀只有硫酸钡,故B错误;
C.乙烯不能使品红褪色,气体应为二氧化硫,故C错误;
D.也可能生成AgCl沉淀,如检验是否含有SO42-,应先加入盐酸,再加入氯化钡检验,故D错误,故选A。
考查方向
解题思路
理解只有胶体具有丁达尔效应,三氧化硫与二氧化硫的不同,品红.酸性高锰酸钾的褪色条件.检验离子的正确方法
易错点
忽略物质的性质
知识点
扫码查看完整答案与解析