- 卤族与氮族及其应用
- 共501题
煤是我国重要的化石燃料,煤化工行业中产生的H2S也是一种重要的工业资源。
19.煤液化是_______(填“物理”或“化学”)变化过程。
20.煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:


21.H2S还可用于回收单质硫。含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图。

正确答案
化学
解析
煤的液化就是以煤为原料生产甲醇的过程,是化学变化
考查方向
本题考查了物质变化的知识点
解题思路
煤液化就是以煤为原料生产甲醇的过程,是化学变化
易错点
煤的焦化,液化,气化这三种操作涉及的均是化学变化。
教师点评
本题考查了物质变化的知识点,在近几年的各省高考题出现的频率较高。
正确答案
①

解析
煤液化过程中产生的H2S可生产硫酸的流程为:煤液化过程中产生的H2S被空气中的氧气氧化成二氧化硫,二氧化硫进一步被氧化成三氧化硫,在吸收塔中冷循环酸吸收三氧化硫生成硫酸。
②H2O2吸收SO2的化学方程式是SO2+H2O2=H2SO4,硫酸与氯化钡反应硫酸钡bg,所以SO2的体积为b/233×22.4L,则尾气中SO2的含量(体积分数)为b/233×22.4V×100%=22.4b/233V×100%
考查方向
本题考查了对工艺流程的理解能力
解题思路
煤液化过程中产生的H2S可生产硫酸的流程为:煤液化过程中产生的H2S被空气中的氧气氧化成二氧化硫,二氧化硫进一步被氧化成三氧化硫,在吸收塔中冷循环酸吸收三氧化硫生成硫酸,以此为突破口。
易错点
化学方程式书写时,注意反应的条件,可逆号;体积分数的表示要乘以百分百
教师点评
本题考查了对工艺流程的理解能力,在近几年的各省高考题出现的频率较高。
正确答案
① H2S+2Fe3+=2Fe2++S↓+2H+② t1时刻后,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O)
解析
含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,硫化氢被铁离子氧化成单质硫,随着时间的推移,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,生成硫,所以n(Fe3+)基本不变,硫化氢不断被氧化成硫单质,
①由图中信息可知,0~t1时,铁离子浓度在下降,所以一定发生的反应是H2S+2Fe3+=2Fe2++S↓+2H+,
故答案为:H2S+2Fe3+=2Fe2++S↓+2H+;
②t1以后,溶液中n(Fe3+)保持基本不变,原因是t1时刻后,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O),
考查方向
本题考查了对工艺流程和从题目中获取信息的能力
解题思路
含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,硫化氢被铁离子氧化成单质硫,随着时间的推移,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,生成硫,所以n(Fe3+)基本不变,硫化氢不断被氧化成硫单质。
易错点
含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,硫化氢被铁离子氧化成单质硫,随着时间的推移,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,生成硫,以此为突破口。
教师点评
本题考查了对工艺流程和从题目中获取信息的能力,在近几年的各省高考题出现的频率较高。
奎尼丁对下述哪一种心律失常无效
A.窦性心动过速
B.心房扑动
C.室性早搏
D.房性早搏
E.房室交界区的早搏
正确答案
A
解析
暂无解析
5.下列实验误差分析错误的是
正确答案
解析
A.湿润的pH值试纸可以稀释碱液,溶液中氢氧根离子浓度减小,测定的溶液碱性减弱,测定值偏小,故A正确;
B.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积,会导致所测溶液体积偏小,故B正确;
C.定容时俯视刻度线,导致所配溶液的体积偏小,结合
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故D正确;
考查方向
本题考查化学实验方案的评价
解题思路
A.湿润的pH值试纸可以稀释碱液;
B.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积;
C.定容时俯视刻度线,导致所配溶液的体积偏小,结合
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大
易错点
B、C项中的误差分析
教师点评
本题考查化学实验方案的评价,在近几年的各省高考题中出现的频率非常高,常与化学实验基本操作、仪器的使用、沉淀的生成与转化、酸性比较、非金属性比较、氧化还原反应等知识点交汇命题
知识点
硝酸铝是一种常用皮革鞣剂。工业上用铝灰(主要合Al、A12O3、Fe2O3等)制取硝酸铝晶体
的流程如下:
完成下列填空:
40.用NaOH固体配制30%的NaOH溶液
41.反应Ⅱ中为避免铝的损失,需要解决的问题是 。
42.从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:
减压蒸发、 、过滤、 、低温烘干。
43.有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因 。
44.某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:

调节pH的目的是 。
为使得到的硝酸铝晶体较纯净,所用的X物质可以是 (填编号)。A.氨水 B.铝 C.氢氧化铝 D.偏铝酸钠
45.该实验室制法与工业上制法相比,其缺点是 。
46.称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,
计算
正确答案
解析
用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,还需要量筒
考查方向
本题考查溶液的配制
解题思路
用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
易错点
质量百分比浓度与物质的量浓度溶液的配制方法区别
教师点评
本题考查溶液的配制,在近几年的各省高考题中出现的频率较高,常与一定物质的量浓度溶液的配制等知识交汇命题
正确答案
如何控制反应终点(或硝酸的用量)
解析
硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,需要解决的问题是:如何控制反应终点(或硝酸的用量),可以将加入稀硝酸改为通入过量CO2,避免氢氧化铝沉淀溶解
考查方向
本题考查实验制备方案
解题思路
反应Ⅰ:铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,
反应Ⅱ:滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失
易错点
对工艺流程的理解、分析
教师点评
本题考查实验制备方案,在近几年的各省高考题中出现的频率较高,常与物质的分离等知识点交汇命题
正确答案
冷却结晶 洗涤
解析
从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干
考查方向
本题考查物质的分离提纯
解题思路
反应Ⅲ:氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体
易错点
过滤后要经过洗涤操作
教师点评
本题考查物质的分离提纯,在近几年的各省高考题中出现的频率非常高,题目难度不大
正确答案
产物中,杂质NaN03的含量较高或后续的蒸发浓缩能耗高
解析
反应Ⅱ、Ⅲ合并以简化操作,产物中杂质NaNO3的含量较高
考查方向
本题考查实验方案的分析与评价
解题思路
产物中杂质NaNO3的含量较高
易错点
反应Ⅱ、Ⅲ的目的
教师点评
本题考查实验方案的分析与评价,在近几年的各省高考题中出现的频率非常高,常与物质的性质、制备实验和性质实验等等知识点交汇命题
正确答案
将Fe3+转化为Fe(OH)3沉淀除去 (1分) BC(2分)
解析
铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,加入的X能与酸反应且不能引入新杂质,故不能选氨水、偏铝酸钠,可以选择Al与氢氧化铝
考查方向
本题考查实验制备方案
解题思路
铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,加入的X能与酸反应切不能引入新杂质
易错点
调节pH时不能引入新杂质
教师点评
本题考查实验制备方案,在近几年的各省高考题中出现的频率非常高,常与物质的性质、制备实验和性质实验等等知识点交汇命题
正确答案
产生大量污
解析
Al与稀硝酸反应会生成NO,污染空气
考查方向
本题考查实验方案的评价
解题思路
反应会生成NO,污染空气
易错点
评价方案要从环保,原材料的消耗量等角度分析
教师点评
本题考查实验方案的评价,在近几年的各省高考题中出现的频率非常高,常与物质的性质、制备实验和性质实验等等知识点交汇命题
正确答案
8.7
解析
根据Al元素守恒
2Al(NO3)3·nH2O ~ Al2O3
2(213+18n) 102
7.392 1.020
解得:n=8.7
考查方向
本题考查结晶水的定量计算
解题思路
利用加热分解过程中的Al守恒
易错点
利用Al的守恒法
教师点评
本题考查结晶水的定量计算,在近几年的各省高考题中出现的频率非常高,题目难度中等
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
15.古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是 (填字母
序号)。 a. Fe b. FeO c. Fe3O4 d. Fe2O3
16.现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
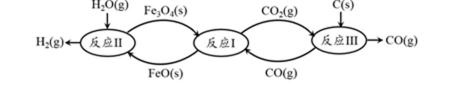



铁氧化物循环裂解水制氢气总反应的热化学方程式是 。 ② 下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
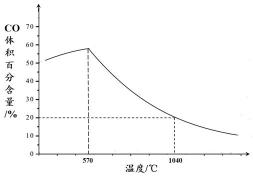
应Fe3O4(s) + 4CO(g) 
由是 。 ii. 随温度升高,反应Fe3O4(s) + CO(g) 
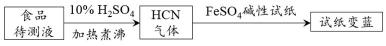
17.① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是 。② 如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用 。
正确答案
c
解析
天然磁石成分为四氧化三铁;
考查方向
本题考查了铁及其氧化物的知识点。
解题思路
古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁。
易错点
磁铁成分主要是四氧化三铁,铁锈成分主要是氧化铁。
教师点评
本题考查了铁及其氧化物的知识点,在近几年的各省高考题出现的频率较高。
正确答案
① C(s) + H2O(g) === H2(g) + CO(g) ΔH == + 134.5 kJ·mol-1 ② i. < (1分)
理由:当其他条件一定时,温度升高,CO的体积百分含量增大,
可逆反应Fe3O4(s)+4CO(g)
解析
①Ⅰ.Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)⇌2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ,
故答案为:C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ;
②i.当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行,图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应,△H<0,
故答案为:<;当其他条件一定时,温度升高,CO的体积百分含量增大,可逆反应Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g) 逆向移动,故△H<0;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1040℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
(1−x)
x=0.8mol/L
K=0.81−0.8=4,
故答案为:增大; 4;
考查方向
本题考查了热化学方程式,反应热,焓变和化学平衡的计算等知识点。
解题思路
①Ⅰ.Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)⇌2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;
②i.图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,结合三行计算列式计算得到平衡浓度,平衡常数K=生成物平衡难度幂次方乘积
;
易错点
注意热化学方程式的书写。
教师点评
本题考查了热化学方程式,反应热,焓变和化学平衡的计算等知识点,在近几年的各省高考题出现的频率非常高。
正确答案
① 3[Fe(CN)6]4- + 4Fe3+ === Fe4[Fe(CN)6]3↓②
碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+; [Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色。
解析
①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓,
故答案为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-
与Fe3+反应生成普鲁士蓝使试纸显蓝色,
故答案为:碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-
与Fe3+反应生成普鲁士蓝使试纸显蓝色.
考查方向
本题考查了离子检验实验设计方案分析判断的知识点
解题思路
①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀;
②若试纸变蓝则证明食品中含有CN-,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-
与Fe3+反应生成普鲁士蓝使试纸显蓝色.
易错点
注意题干信息的运用。
教师点评
本题考查了离子检验实验设计方案分析判断的知识点,在近几年的各省高考题出现的频率较高。
8.下列装置能达到实验目的的是
正确答案
解析
见解题思路。
考查方向
本题考查化学实验装置科学性和可行性。
解题思路
选项A:错误。由于进入右侧高锰酸钾酸性溶液的气体除了乙烯之外,还有乙醇气体,也能使高锰酸钾溶液褪色。
选项B:错误。应该将混合气体通过灼热的碳粉。
选项C:正确。当把氢氧化钠快速推入烧瓶中的时候,CO2气体被吸收,烧瓶中气压下降,导致水蒸气的沸点也下降,因此在不足100℃时也会被蒸馏出来。
选项D:错误。因为氨气极易溶于水,一体积水可以溶解700体积的氨气.即使是饱和的氯化铵溶液也含有很多水,依然可以吸收氨气.
易错点
A选项:学生容易忽略反应物中乙醇也会挥发,也会使高锰酸钾酸性溶液褪色。
D选项:虽然氯化铵溶液中的NH4+会对NH3溶于水产生抑制作用,但是由于氨气在水中的溶解度太大,因而氨气依然会溶于水。
教师点评
本题考查化学实验装置的科学性和可行性,在各省近几年的高考题中出现概率较高。常与元素化合物、化学平衡移动原理、有机化学等知识点交汇命题。
知识点
10.设NA为阿伏伽德罗常数,根据反应
正确答案
解析
见解题思路。
考查方向
本题主要考查阿伏伽德罗常数的应用。
解题思路
选项A:错误。由于没有指明温度和压强,因而22.4L的NO2的物质的量无法确定,所含电子数也就无法确定。
选项B:错误。3.6gH2O的物质的量为0.2mol;1molH2O中的共价键为2mol,因此3.6gH2O中的共价键总数为0.4mol。
选项C:错误。由于Cu2+在溶液中会发生水解,因而实际数目比2NA要少。
选项D:正确。虽然参加反应的Cu和参加反应的硝酸的比例是1:4,但是只有一半的硝酸发生了还原反应,也就是说,被氧化的Cu和被还原的HNO3的比例为1:2,因此,有4molHNO3被还原。
易错点
选项A:容易忽视温度和压强等前提条件。
选项C:容易忽视Cu2+的水解;
选项D:参加反应的HNO3中,只有一半是被还原的,并不是全部的都被还原。
教师点评
本题主要考查阿伏伽德罗常数的应用,在近几年的各省高考题中出现频率较高,常与气体体积、可逆反应、盐类水解、共价键数目等知识点交汇命题。
知识点
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行

完成下列填空:
38.称量样品所用的仪器为 ,将样品研细后再反应,其目的是
。
39.装置a的作用是 。
上述反应结束后,仍需通一段时间的空气,其目的是 。
40.滴定时,标准碘溶液所耗体积为 mL。判断滴定已达终点的现象是
。
41.通过计算可知,该黄铜矿的纯度为 。
42.若用下图装置替代上述实验装置d,同样可以达到实验目的的是 。
正确答案
电子天平 (1分) 提高反应速率,促使黄铜矿充分反应 (1分)
解析
称量样品所用的仪器为天平或电子天平,将样品研细后再反应,其目的是提高反应速率,促使黄铜矿充分反应
考查方向
化学实验基本操作以及仪器的使用
解题思路
称量样品所用的仪器为天平或电子天平,将样品研细后再反应,增大接触面积提高反应速率,促使黄铜矿充分反应
。
易错点
样品研细后再反应的目的
教师点评
本题考查化学实验基本操作以及仪器的使用以及化学反应速率的影响因素
正确答案
除去空气中的水蒸气,便于观察空气流速(2分)
把装置中的二氧化硫气体赶出装置并全部吸收 (1分)
解析
装置a的作用是除去空气中的水蒸气,便于观察空气流速
反应结束后,仍需通一段时间的空气,其目的是把装置中的二氧化硫气体赶出装置并全部吸收
考查方向
化学实验原来与元素化合物性质
解题思路
装置a的作用是除去空气中的水蒸气,便于观察空气流速
反应结束后,仍需通一段时间的空气,其目的是把装置中的二氧化硫气体赶出装置并全部吸收
易错点
装置a的作用
教师点评
化学实验原来与元素化合物性质
正确答案
20.00 (1分) 溶液由无色变成蓝色,并半分钟内不褪色 
解析
滴定时,标准碘溶液所耗体积为20.00mL。判断滴定已达终点的现象是 溶液由无色变成蓝色,并半分钟内不褪色
考查方向
酸碱中和滴定
解题思路
滴定时,标准碘溶液所耗体积为20.00mL。判断滴定已达终点的现象是 溶液由无色变成蓝色,并半分钟内不褪色
易错点
读数和终点的判断描述
教师点评
本题考查酸碱中和滴定相关知识,属于基础题
正确答案
80%
解析
碘的物质的量为0.05mol/L╳0.02L=0.001mol,I2~2I-,,SO2~`SO42-根据得失电子守恒可知,SO2为0.001mol根据硫守恒可知CuFeS2为0.0005mol质量为184g/mol╳0.0005mol=0.92g,纯度为0.92g/1.15g=0.8
考查方向
化学计算
解题思路
碘的物质的量为0.05mol/L╳0.02L=0.001mol,I2~2I-,,SO2~`SO42-根据得失电子守恒可知,SO2为0.001mol根据硫守恒可知CuFeS2为0.0005mol质量为184g/mol╳0.0005mol=0.92g,纯度为0.92g/1.15g=0.8
易错点
守恒思想的应用
教师点评
考查化学计算及守恒思想的应用,属于中等难度题
正确答案
f
解析
本题考查检验SO2的性质,f装置可以根据产生沉淀来进行计算
考查方向
实验装置的考查元素化合物知识及实验装置
解题思路
本题考查检验SO2的性质,f装置可以根据产生沉淀来进行计算
易错点
对性质的掌握不熟悉
教师点评
实验装置的考查元素化合物知识及实验装置
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 条件下进行,目的是为了避免
(2)Br2可用热空气吹出,其原因是
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。
步骤②的产品有时运输到目的地后再酸化,主要是因为
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
A.通入HBr
B.加入Na2CO3溶液
C.加入NaBr溶液
D.加入Na2SO3溶液
正确答案
见解析。
解析
(1)通风橱,污染环境。
(2)
(3)3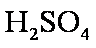
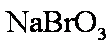
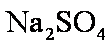
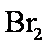
若用盐酸酸化,盐酸会被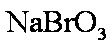
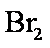
(4)C
知识点
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾,溴,镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O 
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
正确答案
(1)②③④
(2)
(3)



(4) 


解析
略
知识点
扫码查看完整答案与解析