- 卤族与氮族及其应用
- 共501题
回答下列问题。
18.Ⅰ.工业上用电解饱和食盐水制取烧碱和氯气。用于电解的食盐水需要先除去其中的Ca2+、Mg2+、SO42-等离子。其除杂操作时,往粗盐水中先加入过量的 (填化学式),至沉淀不再产生后,再加过量的Na2CO3和NaOH,充分反应后沉淀后将沉淀一并滤去。经过检测发现滤液中仍然含有一定量的SO42-,其原因是 。
[已知:

19.(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中
(2)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)
BaS(s)

2C(s)+O2(g)
则Ba(s)+S(s)+2O2(g)
20.Ⅲ.工业尾气SO2有多种吸收和处理方法。
(1)亚硫酸钠吸收法写出Na2SO3溶液汲收SO2的离子方程式 。
(2)电化学处理法
①如图所示,Pt(1)电极的反应式为 。
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加 mol离子。
正确答案
Ⅰ BaCl2;
BaSO4和BaCO3的Ksp相差不大,当向溶液中加入大量CO32―时,一部分BaSO4(s)转化为BaCO3(s),BaSO4(s)+CO32―(aq)
解析
Ⅰ工业上用电解饱和食盐水制取烧碱和氯气。用于电解的食盐水需要先除去其中的Ca2+、Mg2+、SO42-等离子。其除杂操作时,往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加过量的Na2CO3和NaOH,充分反应后沉淀后将沉淀一并滤去。经过检测发现滤液中仍然含有一定量的SO42-,BaSO4和BaCO3的Ksp相差不大,当向溶液中加入大量CO32―时,一部分BaSO4(s)转化为BaCO3。
考查方向
解题思路
BaSO4和BaCO3的Ksp相差不大。
正确答案
(1)0.0216
(2)-1473.2kJ/mol
解析
(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中
(2)已知:BaSO4(s)+4C(s)
BaS(s)

2C(s)+O2(g)
则Ba(s)+S(s)+2O2(g)
考查方向
解题思路
(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中
(2)已知:BaSO4(s)+4C(s)
BaS(s)

2C(s)+O2(g)
则Ba(s)+S(s)+2O2(g)
易错点
BaSO4和BaCO3的Ksp判断、盖斯定律的计算、Pt(1)电极的反应式的书写。
正确答案
(1)SO32-+SO2+H2O
(2)①
解析
(1)亚硫酸钠吸收法,Na2SO3溶液汲收SO2的离子方程式SO32-+SO2+H2O
(2)①如图所示,Pt(1)电极的反应式为①
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加0.03mol 离子。
考查方向
解题思路
(1)亚硫酸钠吸收法,Na2SO3溶液汲收SO2的离子方程式SO32-+SO2+H2O
(2)①如图所示,Pt(1)电极的反应式为①
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加0.03mol 离子。
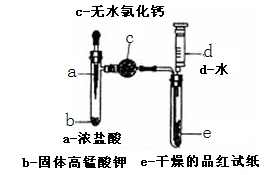
某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
8.将a中浓盐酸挤入试管中,发生反应的化学方程式为 。
9.仪器c的名称为 ,其中固体也可用 代替。
10.当试管e中充满黄绿色气体时,观
11.注射器在实验中除了可向试管e中加水,还有 的作用。
正确答案
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
解析
(1)a中是浓盐酸与高锰酸钾反应制取氯气,化学方程式是2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(2)干燥管;P2O5或硅胶一般不用无水CuSO4。
解析
(2)仪器c是球形干燥管——目的是吸收水蒸气,以获得干燥的氯气、并通过干燥的品红试纸检验氯气有无漂白性;氯气与碱性干燥剂反应,所以只要是酸性或中性干燥剂,如P2O5或硅胶也可以。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(3)没有;有;干燥的氯气不能使品红试纸褪色,氯气溶于水后,和水反应能生成HClO具有强氧化性,能使品红试纸褪色。
解析
(3)当试管e中充满黄绿色气体时,e中的品红试纸不变色,说明干燥的氯气无漂白性;再将注射水入e后,品红试纸褪色,说明是生成的HClO有漂白性。由此得出的结论是:干燥的氯气不能使品红试纸褪色,氯气溶于水后,生成具有强氧化性的HClO,能使品红试纸褪色。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(4)反应结束后,可向上拉针栓,从试管中抽出氯气,起到储存多余氯气的作用,防止氯气的污染。
解析
(4)反应结束后,可向上拉针栓,从试管中抽出氯气,起到储存多余氯气的作用,防止氯气的污染。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
易错点
(4)注射器在实验中除了可向试管e中加水,还有的作用?。
1.下列有关说法中正确的是( )
正确答案
解析
A.乙醇消毒液消毒是因为可以使蛋白质变性,而并非是将病毒氧化,而次氯酸钠溶液可以将病毒氧化而达到消毒的目的,A错误;
B.绿色化学是指化学反应过程中以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”.不仅充分利用资源,而且不产生污染,B错误;
C.晶体管材料应具有导电性,锗电子迁移率比硅强,可用于半导体材料,C正确;
D.纤维素在人体中不能水解生成葡萄糖,需要浓硫酸催化剂作用发生水解,D错误。
故选C。
考查方向
解题思路
A.乙醇使蛋白质变性;
B.绿色化学的核心内容之一是“原子经济性”;
C.晶体管材料应具有导电性;
D.纤维素在人体中不能水解生成葡萄糖。
易错点
本题考查了生活中的化学知识应用,物质的存在和分析判断,掌握基础是关键,题目较简单。
知识点
“霾”是当今世界环境热点话题。目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+ 2CO(g)
8.在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
①0~15min N2的平均速率v(N2)= ;NO的转化率为 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积
b.增加CO的量
c.降低温度
d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”),重新达到平衡后,该反应的化学平衡常数为 。
9.已知:2NO(g)+O2(g)=2NO2(g) △H=﹣bkJ•mol-1(b > 0)
CO的燃烧热△H=﹣ckJ•mol-1 (c > 0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式为: 。
10.工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 极,电解池中生成N2O5的电极反应式是 。
正确答案
①0.013mol/(L•min) 40%
②c d
③向左 
解析
①v(N2)=
②因为反应为放热反应在,且是一个正向气体计量系数减小的反应。 缩小容器体积,平衡正向移动,CO的物质的量在减少,但由于容器的体积也在减小,所以浓度增大,a错误。增加CO的量,其平衡浓度增大,b错误。降低温度平衡正向移动,CO的量减小,达到新平衡后其浓度下降,c正确。扩大容器体积,平衡逆向移动,CO的物质的量虽然增大,但由于容器体积也增大,最后CO的浓度下降,d正确。
③平衡常数是温度的函数,K=

考查方向
解题思路
加强对化学反应原理知识的理解,对涉及的知识能快速找到相应的解决方法。
易错点
平衡移动原理、电极反应方程式书写
正确答案
4CO(g)+2NO2(g)⇌N2(g)+4CO2(g) △H=﹣a+b﹣2c kJ•mol-1
解析
考查方向
选修四化学反应原理综合题,涉及化学平衡、化学反应与能量变化、电化学等知识。
解题思路
加强对化学反应原理知识的理解,对涉及的知识能快速找到相应的解决方法。
易错点
平衡移动原理、电极反应方程式书写
正确答案
阴 N2O4+2HNO3-2e- = 2N2O5 + 2H+
解析
Pt乙电极中HNO3 得到N2O4化合价降低,发生还原反应,因此为阴极。Pt甲中N2O4失电子发生氧化反应,结合电解质溶液环境,电极反应为:N2O4+2HNO3-2e- = 2N2O5 + 2H+
考查方向
选修四化学反应原理综合题,涉及化学平衡、化学反应与能量变化、电化学等知识。
解题思路
加强对化学反应原理知识的理解,对涉及的知识能快速找到相应的解决方法。
易错点
平衡移动原理、电极反应方程式书写
4.下列实验操作及现象结论描述不准确的是( )
正确答案
解析
苯酚与溴水反应会生成三溴苯酚白色沉淀,但由于苯酚过量,三溴苯酚会溶解在其中,A正确。
由于镁离子与铜离子浓度相同,且溶度积的表达示相同,先沉淀的KSP越小,故B正确。
中和热的测定,是利用酸碱之间反应,通过反应前后温度的变化进行计算,依据原理,选项中所给的仪器便可完成试验,故C正确。
实验室制乙烯时,挥发出的乙醇也能使酸性高锰酸钾褪色,故D错误。
考查方向
解题思路
对高中化学重要的实验的原理、操作、现象、注意事项进行再整理,做到知其然,知其所以然。
易错点
苯酚与溴水的反应现象只知会形成沉淀,不明白与反应的量有关,苯酚过量时沉淀会溶解。
知识点
高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色。
实验流程如下:
请回答:
8.步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯
B.蒸发皿
C.瓷坩埚
D.铁坩埚
9.①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
A.二氧化硫
B.稀醋酸
C.稀盐酸
D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
③下列监控K2MnO4歧化完全的方法或操作可行的是 。
A.通过观察溶液颜色变化,若溶液颜色
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.取上层清液少许于试管中,加入还原剂如亚硫酸钠溶液,若溶液紫红色褪去,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
10.烘干时,温度控制在80℃为宜,理由是 。
11.通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时先将草酸晶体(H2C2O4·2H2O)配成标准溶液,实验室常用的容量瓶规格有100mL、250mL等多种,现配制90mL 1.5mol·L-1的草酸溶液,需要称取草酸晶体的质量为 g。
②量取KMnO4溶液应选用 (填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将 (填“偏大”、“偏小”或“不变”)。
正确答案
D
解析
熔融固体物质需要在坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚,故而选D
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
酸碱式滴定管的选取
正确答案
①B
②CO2与K2CO3溶液反应生成KHCO3,结晶时会同KMnO4一起结晶析出,产品纯度降低
③B
解析
①B
②CO2与K2CO3溶液反应生成KHCO3,结晶时会同KMnO4一起结晶析出,产品纯度降低
③B
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
酸碱式滴定管的选取
正确答案
温度过高,产品受热分解,温度过低,烘干时间长
解析
温度过高,产品受热分解,温度过低,烘干时间长
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
酸碱式滴定管的选取
正确答案
①18.9g
②酸式 偏小
解析
①n=cv=0.1 L×1.5mol·L-1=0.15mol,m=nM=0.15mol×126g/mol=18.9g
②KMnO4溶液具有氧化性,腐蚀橡胶管,故而选择酸式滴定管;偏小。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
酸碱式滴定管的选取
3.下列有关实验原理、操作及安全知识的叙述,正确的是()
正确答案
解析
形成溶液后,污染面积更大,故A错误;
银氨溶液应现用现配,放置时间过长会发生变质,氢氧化铜悬浊液应现用现配,放置时间过长会变为沉淀,氯水能与水反应生成次氯酸,次氯酸见光易分解,放置时间过长会变为沉淀,故B正确;
氯代烃在碱性条件下水解,如直接加入硝酸银生成氢氧化银沉淀而干扰实验现象,应先酸化,故C错误;
NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱,故D错误。
考查方向
解题思路
A:形成溶液后,污染面积更大;
B:银氨溶液应现用现配,放置时间过长会发生变质,氢氧化铜悬浊液应现用现配,放置时间过长会变为沉淀,氯水能与水反应生成次氯酸,次氯酸见光易分解,放置时间过长会变为沉淀;
C:氯代烃在碱性条件下水解,如直接加入硝酸银生成氢氧化银沉淀而干扰实验现象,应先酸化,故C错误;
D:NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱。
易错点
对化学原理、操作及安全知识理解不透彻,易混淆
知识点
7.室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
正确答案
解析
A.a点所示溶液中显碱性,HA为弱酸。
B.pH=7时,溶液显中性,HA的用量多于NaOH;
C.a点溶液中水电离出c(H+)浓度=10-14/10-8.7 b点溶液中水电离出c(H+)浓度=10-14/10-4.7
D.b点处HA过量了,中和完NaOH后HA有剩余10ml。
考查方向
解题思路
A.a点所示溶液中显碱性,根据题目得出正电荷总数大于负电荷数与电荷守恒判断不符合。
B.pH=7时,溶液显中性;
C.a点溶液中水电离出c(H+)浓度=10-14/10-8.7 b点溶液中水电离出c(H+)浓度=10-14/10-4.7
D.b点HA过量
易错点
酸碱混合后的定性判断及溶液中离子浓度大小比较,掌握溶液酸碱性与溶液pH的计算方法,能够根据电荷守恒、物料守恒等比较溶液中离子浓度大小。
知识点
5. 下列叙述正确的是( )
正确答案
解析
A. CH3COONa的水解显碱性,溶液中c(OH-) >c(H+),故错误;
B. Na2CO3溶液加水稀释,越稀越水解,但是加水使溶液体积增大得多,而水解生成的OH-增大得少,故c(OH-)降低,pH减小,选项错误;
C. 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等是正确的;
D. 在Na2S溶液中加入AgCl固体,会出现沉淀的转化——AgCl转化为溶度积更小的Ag2S,溶液中c(S2-)会发生变化,故选项错误。
考查方向
解题思路
依据电离平衡、水解平衡、溶度积等原理解题。
易错点
易错选B。
知识点
6.已知:含碳碳双键的物质一定条件下能与水发生加成反应生成醇,有机物A—D间存在图示的转化关系。下列说法不正确的是 ()
正确答案
解析
由C经催化氧化得到乙酸,可以推断出A为乙烯,B为乙醇,D为乙酸乙酯。乙烯能被高锰酸钾氧化,使其褪色,A正确。因为酒精与水可以互溶,所以不能用它碘水中的碘单质,B错误。乙醇与乙酸发生的酯化化反应也是取代反应中的一种类型,C正确。乙酸乙酯的结构简式为:C
考查方向
解题思路
本题比较简单,从C被氧化成乙酸进行突破,再推出其它物质,得到正确结论。
易错点
有机知识记忆不清
知识点
扫码查看完整答案与解析