- 卤族与氮族及其应用
- 共501题
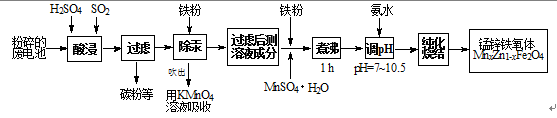
一种以黄铁矿(主要含FeS2)为原料制备磁性纳米四氧化三铁的工艺流程如下,
其中缎烧后的烧渣含有(Fe2O3,、SiO2、FeO),回答下列问题:
19.缎烧时的主要方程式为
(填“氧化”或“还原”);当有lmolSO2生成时,转移的电子数为 mol。
20.尾气中的SO2对环境有污染,一种电化学治污的装置如右图,通SO2一侧的电极反应式为
21.酸溶时需保持盐酸过量,其目的是
22.若不能产生新的杂质,在调节比例前检测发现n (Fe2+)/ n(Fe3+)偏高,则加入的A是 〔填化学式),若比例偏低,加入的A是 (填化学式)。
23.写出沉淀发生的离子反应方程:
24.沉淀步骤中维持n(Fe2+)/ n(Fe3+)比例和控制一定的条件对得到高纯度的纳米级磁性F3O4非常关键,根据Fe2+、Fe3+的性质和下边提供的数据,在实际生产中需要采取的措施是
正确答案
【答案】略
正确答案
略
正确答案
略
正确答案
略
正确答案
略
正确答案
略
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
正确答案
解析
本题通过NH3的制取实验,意在考查考生实验分析、实验评价能力。①装置在管口处又生成NH4Cl,无法制得NH3,A项错误;选用装置③,使用浓氨水与CaO或NaOH作用,可制取NH3,B项正确;②作为NH3的吸收装置,漏斗插入水中,不能防止倒吸,C项错误;利用④收集NH3时,收集气体不纯,D项错误。
知识点
9.关于明矾的叙述正确的是
正确答案
解析
A、明矾是硫酸铝钾晶体,化学式是KAl(SO4)2●12H2O是一化合物,是一种纯净物;在水中会发生电离,KAl(SO4)2●12H2O=K+ +Al3++2SO42-+12H2O,A错;
B、Al3+在水中会发生水解生成Al(OH)3胶体,不是沉淀,所以B错误;
C、Al(OH)3胶体的表面积比较大,所以具有吸附性,可以吸附一些杂质。不是因为具有强氧化性,所以不具有杀菌、消毒的作用;
D、Fe3+也可以发生水解生成Fe(OH)3胶体。所以硫酸铁可以代替明矾,答案正确。
考查方向
本题考查明矾中Al3+的水解
解题思路
明矾是硫酸铝钾晶体,化学式是KAl(SO4)2●12H2O是一化合物,是一种纯净物;在水中会发生电离,KAl(SO4)2●12H2O=K+ +Al3++2SO42-+12H2O;Al3+在水中会发生水解生成Al(OH)3胶体,Al(OH)3胶体的表面积比较大,所以具有吸附性,可以吸附一些杂质。Fe3+也可以发生水解生成Fe(OH)3胶体。
易错点
Al3+水解程度较弱,不能生成沉淀;明矾净水原理是胶体表面积比较大吸附性,不具有杀菌消毒的作用。
教师点评
此题比较基础,考查的是明矾物质的名称和作用,其水溶液的Al3+水解;胶体的性质。
知识点
【化学——化学与技术】(15分)(选做题)
锰锌铁氧体是应用广泛的高性能磁性材料。现以a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b %,MnOOH占c %)制备锰锌铁氧体,主要流程如下:
21.酸浸废电池时,SO2的作用是 (填字母编号)。
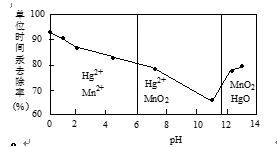
22.除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。右图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO-4在该pH范围反应的主要产物。
① pH<6时反应的离子方程式为___________。
② 汞的去除速率随pH变化的规律是_________。
23.锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)==2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)==MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是 。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为 。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O) kg。(只列出计算式)
正确答案
考查方向
本题考查了氧化还原反应的应用
解题思路
从工艺流程最后可看出,锰元素的化合价为+3价,但废旧电池中分别为+3、+4,推出SO2 的作用是做还原剂。
教师点评
本小题考查了氧化还原反应的应用,在高考中氧化还原反应是难点也是热点,出现频率高。
正确答案
① 2MnO4-+5Hg+16H+==2Mn2++5Hg2++8H2O(3分)
②随pH增大,汞的去除速率先减小后增大(1分)
考查方向
根据条件写陌生离子方程式和图表分析能力
解题思路
第一空:根据题目所限制的条件,找到pH<6(酸性条件)是锰的元素和汞元素的存在形式再书写离子方程式。
第二空:看图像分析曲线的变化趋势。
易错点
书写离子方程式忽视酸性条件
教师点评
本题考查了离子方程式的书写和信息提取的能力,在高考中出现频率高。
正确答案
2MnCO3(s)+O2(g)==2MnO2(s)+2CO2(g) ∆H=-38.8 kJ/mol(3分)
考查方向
热化学方程式书写和盖斯定律
解题思路
2MnO(s)+O2(g)=2MnO2(s) ∆H1=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H2=+116.6 kJ/mol
2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) ∆H=∆H1+2∆H2
教师点评
本题考查了热化学方程式的书写及盖斯定律,是高考中出现评论高。
正确答案
MnO·4ZnO·5Fe2O3(2分) 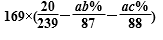
解析
x=0.2时,Mn0.2Zn0.8Fe2O4
100Kg Mn0.2Zn0.8Fe2O4 : n(Mn2+) =0.2x100kg/239g.mol-1
MnO2占b %,MnOOH占c %,即已经含有的 n(Mn2+)=ab%/87g.mol-1+ac%/88g.mol-1
需要补充的n(Mn2+)=0.2x100kg/239g.mol-1-ab%/87g.mol-1+ac%/88g.mol-1
m(MnSO4)=169x(0.2x100kg/239g.mol-1-ab%/87g.mol-1+ac%/88g.mol-1)
解题思路
第一空:x=0.2时,Mn0.2Zn0.8Fe2O4
同时扩大5倍:MnZn4Fe10O20
改写成氧化物形式:MnO·4ZnO·5Fe2O3
第二空:见解析
教师点评
本题考察了复盐的氧化物表示形式,在高考中出现较少。同事考查了简单的与物质的量有关的计算,在高考中出现频率中等。
利用下列装置分别完成相关实验,不能达到实验目的的是
正确答案
解析
略
知识点
用下列装置进行相应实验,能达到实验目的的是
正确答案
解析
略
知识点
33.NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为( )
(2)按图13装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是( ),原因是( ),稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是( ) 。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究 ( )对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为( )(只列出算式,忽略水自身电离的影响)。
正确答案
(1)ACG
(2)①产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,氯化铵小颗粒形成白烟。②烧杯中的石蕊溶液会倒流进入到B瓶中。
(3)①温度
②
③(10-Y×5.35)/m
解析
解析已在路上飞奔,马上就到!
知识点
下列装置或操作不能实现实验目的的是
正确答案
解析
略
知识点
9.下列实验装置或操作正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.下图所示为制取干燥的氨气,并验证氨的某些性质,请根据要求回答下列问题

NO+ NO2+ NaOH= NaNO2+ H2O
用该原理处理为气的不足之处是( );
(2)上述装置接口的连接顺序为( ) (填小写字母)。
(3)如何检验装置A的气密性:( )。
实验中观察到D内有红棕色气体出现,证明氨气具有( )性。
(4)右图所示为实验室制取氨气的发生装置,请在虚线框内画出收集氨气的装置图。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析