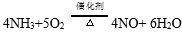- 卤族与氮族及其应用
- 共501题
叶酸可以由下列甲、乙、丙三种物质合成。
42.甲的最简式为 ;丙中含有官能团的名称为 。
43.下列关于乙的说法正确的是 (填序号)。
44.甲在一定条件下能单独聚合成高分子化合物,请写出该反应的化学方程式: 。
45.甲可以通过下列路线合成(分离方法和其他产物已经略去):
(1)步骤Ⅰ的反应类型是 。
(2)步骤I和IV在合成甲过程中的目的是 。
(3)步骤IV反应的化学方程式为 。
正确答案
C7H7 NO2 ;羧基、氨基
解析
根据结构简式确定分子式为C7H7NO2;丙中官能团是氨基和羧基
考查方向
有机物最简式、官能团
解题思路
根据结构简式确定分子式;丙中官能团是氨基和羧基
易错点
官能团的名称
教师点评
本题考查有机物的分子式、官能团,属于基础性知识,题目较简单
正确答案
解析
a.该分子中C、N原子个数分别是7、5,所以分子中碳原子与氮原子的个数比是7:5,故正确;
b.含有苯环的有机物属于芳香族化合物,该分子中没有苯环,所以不属于芳香族化合物,故错误;
c.氨基能和酸反应、氯原子能和碱溶液反应,所以该物质既能与盐酸又能与氢氧化钠溶液反应,故正确;
d.该分子中含有N原子,不属于苯酚的同系物,故错误
考查方向
有机物的结构和性质
解题思路
a.该分子中C、N原子个数分别是7、5;
b.含有苯环的有机物属于芳香族化合物;
c.氨基能和酸反应、氯原子能和碱溶液反应;
d.该分子中含有N原子;
易错点
易错判该结构中含有苯环
教师点评
本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,题目难度不大
正确答案
解析
甲中氨基和羧基能发生缩聚反应生成高分子化合物,反应方程式为:
考查方向
有机化学反应
解题思路
甲中氨基和羧基能发生缩聚反应生成高分子化合物
易错点
聚合反应中的n易漏写
教师点评
本题主要考查有机化学反应,根据结构中含有的官能团的性质进行分析,题目难度不大
正确答案
(1)取代反应 (2)保护氨基 (3)
解析
反应I是取代反应、反应II是加成反应、反应III是氧化反应生成戊,醛基被氧化生成羧基,戊水解生成甲,
i.步骤Ⅰ的反应类型是取代反应
ii.步骤 I和 IV在合成甲过程中的目的是保护氨基
iii.IV反应的化学方程式为:
考查方向
有机合成
解题思路
反应I是取代反应、反应II是加成反应、反应III是氧化反应生成戊,醛基被氧化生成羧基,戊水解生成甲
易错点
步骤 I和 IV在合成中的目的
教师点评
本题考查有机合成,明确流程图中发生的反应及反应中断键和成键方式是解本题关键,侧重考查学生分析判断能力,题目难度不大
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。
化学课外活动小组研究莫尔盐晶体强热时的分解产物。
16.乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。

15.甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是__________,由此可知分解产物中有____________。
正确答案
①G D B C F ②吸收氨气并将溶液酸化,排除SO2的干扰 D中出现白色沉淀
解析
①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、D、B、C、F;
②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色,所以装置D中足量盐酸的作用是 吸收氨气并将溶液酸化,排除SO2的干扰;含有SO3的实验现象是 D中有白色沉淀
考查方向
性质实验方案设计
解题思路
①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,据此答题;
②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色
易错点
各连接装置的作用
教师点评
本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度中等
正确答案
溶液变红 NH3
解析
莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色,所以装置C 中可观察到的现象是溶液变红,由此可知莫尔盐晶体分解的产物中有 NH3.装置B的主要作用是吸收分解产生的酸性气体
考查方向
性质实验
解题思路
莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色
易错点
摩尔盐的分解产物
教师点评
本题考查性质实验,明确各部分装置的作用是解答本题的关键,题目难度不大
下列实验过程中,始终无明显现象的是
正确答案
解析
略
知识点
化学无处不在,下列与化学有关的说法,不正确的是()
正确答案
解析
A对,侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出。
B对,浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,为白烟。
C错,碘是人体必需元素,补碘常在食盐中加入KIO3固体而不是高碘酸,高碘酸为强酸性物质。
D对,制备黑火药的原料为S、KNO3、C,三者比例为1:2:3
知识点
工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图:
(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式__________________。
(2)用活性炭吸附生成的单质碘的目的是__________________________,用浓、热NaOH洗脱吸附的碘的化学方程式为___________________________________。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是___________;若取少量该溶液在实验室中分离得到单质碘,需要进行的操作为__________________。
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:________________________________。
(5)工业上虚框内流程还可用如右图操作代替,评价右图流程的优点___________________________(写出一条)。
正确答案
(1)2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O
(2)富集单质碘; 3I2 + 6NaOH → NaIO3+ 5NaI+ 3H2O
(3)单质碘在水中溶解度小,易升华; 萃取 分液 蒸馏
(4)4NaOH+ O2+ 4NO → 4NaNO2+ 2H2O
(5)减少了化学药品的投入量,使成本大大降低。(或生产环节减少;或药品对设备无腐蚀性等)
解析
略
知识点
33.NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为( )
(2)按图13装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是( ),原因是( ),稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是( ) 。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究 ( )对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为( )(只列出算式,忽略水自身电离的影响)。
正确答案
(1)ACG
(2)①产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,氯化铵小颗粒形成白烟。②烧杯中的石蕊溶液会倒流进入到B瓶中。
(3)①温度
②
③(10-Y×5.35)/m
解析
解析已在路上飞奔,马上就到!
知识点
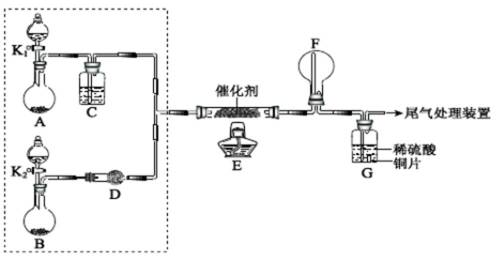
某小组同学欲探究NH3催化氧化反应,按下图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)NH3催化氧化的化学方程式是 。
(2)装置B中产生气体的原因有(结合化学用语解释) 。
(3)甲乙两同学分别按上述装置进行实验。一段时间后,装置G中溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是 。
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式) 。
③用离子方程式解释装置G中溶液变成蓝色的原因: 。
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。
①甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”)
装置A中的产气量,或(填“增加”或“减少”) 装置B中的产气量。
②乙认为可在装置E、F间增加一个装置,该装置可以是(填序号) 。
(5)为实现该反应,也可用下图所示的装置替换上述
装置中虚线框部分,化合物X为 。
NH4HCO3的作用是 。
正确答案
见解析。
解析
(1)
(2)在氨水中存在平衡:NH3 + H2O 

(3)①2NO+O2==2NO2
②NH4NO3
③3Cu+ 8H++2NO3—=3Cu2+ +2NO↑+4H2O
(4)①增加 减少
②abc
(5)Na2O2
NH4HCO3分解放出NH3;同时放出的CO2和H2O与Na2O2反应生成O2
知识点
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
正确答案
见解析。
解析
(1)偏高
(2)湿润的红色石蕊试纸 试纸颜色由红变蓝
(3)n(Ni2+)= 0. 04000 mol·L-1×31. 25 mL×10-3L·mL-1 =1. 250×10-3 mol
n(NH4 +)= =2. 500×10-3 mol
n(SO42-)= ==2. 500×10-3mol
m(Ni2+)= 59 g·mol-1×1. 250×10-3 mol=0. 07375 g
m(NH4+)= 18 g·mol-1×2. 500×10-3 mol=0. 04500 g
m(SO42-)= 96 g·mol-1×2. 500×10-3 mol=0. 2400 g
n(H2O)= 1. 250×10-2 mol
x :y :m:n= n(NH4+):n(Ni2+):n(SO42-):n(H2O)= 2:1:2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
知识点
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是()
正确答案
解析
略
知识点
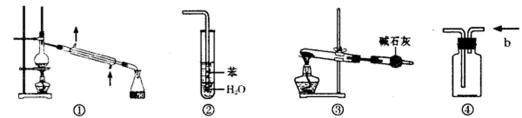
13.实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析