- 卤族与氮族及其应用
- 共501题
1.化学与生活密切相关。下列应用中利用了物质氧化性的是
正确答案
解析
四个选项中只有“D.漂白粉漂白织物”是漂白粉的水解产物次氯酸氧化色素漂白织物的。选D。A.明矾净化水是Al3+的水解;B.纯碱去油污是CO32-的水解; C.食醋除水垢是CaCO3与醋酸的复分解反应。
考查方向
解题思路
针对题目——物质的氧化性直接解题。
易错点
对氧化性、酸性、水解等性质分辨有误。
知识点
工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
回答下列问题:
28.制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
29.制取无水氯化亚铁的实验中,装置A用来制取 。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
30.若操作不当,制得的FeCl2 会含有少量FeCl3 ,检验FeCl3常用的试剂是 。欲制得纯净的FeCl2 ,在实验操作中应先 ,再 。
正确答案
MnO2 + 4HCl(浓) 
解析
依据“制取无水氯化铁的实验”首先要获得干燥的氯气,可得A为实验室制取氯气装置,其化学方程式的书写属于送分;B为干燥装置——液体干燥剂浓硫酸。
考查方向
解题思路
实验室制氯气原理。
易错点
方程式书写不规范,如漏条件、或(浓)等。
正确答案
HCl;HCl和H2;发生倒吸、可燃性气体H2不能被吸收。
解析
依据“制取无水氯化亚铁”得:A为实验室制取氯化氢装置(此处答化学式或名称均可),B仍盛浓硫酸洗气干燥,因此尾气就有剩余的HCl和生成的H2。HCl极易溶于水,故仍用装置D可能发生倒吸,另H2是可燃性气体却不能被吸收,存在安全隐患(A装置在加热,有火源)。
考查方向
解题思路
依据题给制取氯化亚铁信息解题。
易错点
“尾气的成分”回答不全,“存在的问题”寻找不全。
正确答案
KSCN溶液;点燃A处的酒精灯,点燃C处的酒精灯。
解析
①“检验FeCl3常用的试剂”——从常用即可联想到KSCN溶液;也正因为“常用”,所有就不能用苯酚、亚铁氰化钾、甚至NH4SCN溶液之类,也因为是在亚铁离子里检验少量的铁离子,故也不用NaOH溶液。②“欲制得纯净的FeCl2”,最容易出现的杂质就是加热时被容器内的空气氧化而形成氧化物,因此要想办法先赶跑反应器内的空气——即点燃A处的酒精灯,制备HCl,利用HCl来排除反应器内的空气,再点燃C处的酒精灯,以制备氯化亚铁。
考查方向
解题思路
实验的基本原理及题给信息的整合。
易错点
“常用”试剂、操作的先后。
16.在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是 。(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式: 。(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是A.酸性:HF>HCl>HBr>HI B.键能:H—F>H—Cl>H—Br>H—IC.熔点:HF
正确答案
(1)第3周期ⅦA族 (2)

解析
(1) 氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,则应位于周期表第三周期ⅦA族;(2) 次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为:



考查方向
解题思路
(1) 氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,则应位于周期表第三周期ⅦA族;(2) 次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为:
易错点
本题综合考查氯的化合物的性质以及卤素的性质比较,题目较为综合,难度较大,注意把握题给信息,尤其是氧化还原反应知识的运用。
知识点
7.下列各组数据比较,前者比后者小的是
正确答案
解析
A.氯水中有Cl2、H2O、H+、Cl-、HClO、ClO-、OH-等7种微粒,氨水中有NH3、H2O、NH3·H2O、NH4+、OH-、H+等6种微粒,比氯水少;
B.乙烷中的碳碳单键比苯分子中特殊的碳碳键的键长长;
C.铯与钠同在IA族,且铯离子的半径比钠离子大,故氯化铯的熔点低于氯化钠的熔点,是符合题意的选项;
D.Al2O3是离子晶体,熔点远高于属于分子晶体的AlCl3。
考查方向
解题思路
氯气、氨气与水反应的性质、有机物分子中的碳碳键、物质的熔沸点规律。
易错点
氯水与氨水中微粒种类。
知识点
18.向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是
正确答案
解析
向饱和食盐水中滴加一定浓度的盐酸,若盐酸浓度较高,则会使食盐的溶解平衡向着结晶的方向移动,故A.可能;若盐酸浓度较低,反而是稀释饱和食盐水,则C.可能。
考查方向
解题思路
一定浓度的盐酸的加入,可能破坏饱和食盐水中的溶解平衡。
易错点
预测可能的现象,易漏选。
知识点
13.已知氯水中存在反应:
正确答案
解析
A.加5 mL水相当于稀释c (H+)减小
B.加少量NaCl固体,c (Cl-)增大,平衡逆向移动,c (H+)减小
C.加少量碳酸钙粉末,消耗氢离子,平衡正向移动,c(HClO)升高 所以正确
D.加少量
考查方向
解题思路
对于这个反应只能从各物质浓度的变化去考虑平衡的移动
易错点
纯液体没有浓度,增多或减少不影响浓度
知识点
15.有某温度下KCl饱和溶液m1 g,溶质质量分数为ω1%。对其蒸发结晶或降温结晶,若析出KCl的质量、所得母液质量及溶质质量分数用m g、m2 g和ω2%表示,分析正确的是
正确答案
解析
A.原条件下KCl的溶解度较大,大于ω1 g ,故A错误;
B. 依据溶质的量守恒,前后溶液中溶质的差值即为 m1∙ω1% - m2∙ω2%= m,故B正确;
C.只有降温结晶时ω1大于ω2 ,故C.错误;
D.因蒸发结晶有溶剂损失,则 m1 - m2 ≥m,故D.错误。
考查方向
解题思路
蒸发结晶,析出晶体,还要损失溶剂;而降温结晶则只析出晶体。但是溶质的量守恒。
易错点
前后溶液的质量差D. m1 - m2 ≤ m。
知识点
亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38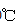
28.
a.将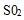
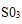
b.稀释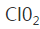
c.将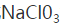
29.吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是____。
30.从“母液”中可回收的主要物质是 。
31.从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:
①减压,55℃蒸发结晶;
②_______________;
③ ___________________;
④低于60℃干燥,得到成品。
从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体; 从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:
①减压,55℃蒸发结晶;
②过滤;
③38-60℃温水洗涤;
④低于60℃干燥,得到成品。
正确答案
2ClO3-+SO2=2ClO2↑+SO42- b
解析
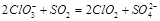
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
ClO3-中氯元素为+5价做氧化剂, SO2具有还原性。
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,防止H2O2分解
解析
吸收塔中发生的是二氧化氯与氢氧化钠、过氧化氢发生反应生成亚氯酸钠(NaClO2),Cl元素的化合价降低,则过氧化氢中的O元素的化合价升高,所以产物在还有氧气生成,根据元素守恒可知产物中有水生成,所以化学方程式是2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;过氧化氢受热易分解,所以吸收塔的温度不能超过20℃;
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
吸收塔中发生的是二氧化氯与氢氧化钠、过氧化氢发生反应生成亚氯酸钠(NaClO2),Cl元素的化合价降低,则过氧化氢中的O元素的化合价升高;过氧化氢受热易分解;
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
Na2SO4
解析
从“母液”中可回收的主要物质是Na2SO4;
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
从“母液”中可回收的主要物质是Na2SO4;
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
过滤;38-60℃温水洗涤
解析
从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体; 从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:
①减压,55℃蒸发结晶;
②过滤;
③38-60℃温水洗涤;
④低于60℃干燥,得到成品。
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体; 从吸收塔中可获得NaCl02溶液。
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
正确答案
74.21%
解析
因为是用Na2S203标准液滴定到终点,反应是I2+2S2O32-= 2I-+S4O62-,,I2与指示剂淀粉产生蓝色,故由反应中I元素守恒可知,ClO2-----2I2---- S4O62-25.00 mL待测液计算出n(NaClO2);再计算出m(NaClO2)样品中该样品中NaClO2的质量分数为74.21%。
考查方向
本题主要考查了物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计。
解题思路
因为是用Na2S203标准液滴定到终点,反应是I2+2S2O32-= 2I-+S4O62-,,由反应中I元素守恒,ClO2-----2I2---- S4O62-计算。
易错点
本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点。
9.某厂用Na 除掉苯中的水分。某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na 。下列处理方法更合理、更安全的是
正确答案
解析
A、打开反应釜,将Na 暴露在空气中与氧气反应,钠暴露在空气中会与空气中的水和氧气反应,但钠与水反应放出大量热;
B、向反应釜通入Cl2 ,钠在氯气中燃烧会放出大量的热;
C、向反应釜加大量H2 O,钠与水反应放出大量的热;
D、向反应釜滴加C2 H5 OH,并设置放气管,排出氢气和热量,反应速度相对缓慢,更安全、更合理。
考查方向
本题主要考查了实验室安全及钠的相关化学知识。
解题思路
A、钠暴露在空气中会与空气中的水和氧气反应;
B、钠在氯气中燃烧;
C、钠与水反应属于放热反应;
D、C2 H5 OH中C-O-H中0-H可断键。
易错点
向反应釜加大量H2 O,通过化学反应“除掉”金属钠,钠与水反应属于放热反应;C2 H5 OH中C-O-H中0-H可断键。
知识点
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2 + Cl2 + SCl2=2SOCl2,部分装置如右下图所示,回答以下问题:
14.仪器c的名称是 ,装置f的作用是 。
15.实验室制Cl2的化学方程式为 。
16.SOCl2与水反应的化学方程式为 。蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因: 。
17.下列四种制备SO2的方案中最佳选择是 。
18.装置e中产生的Cl2经过d后进入三颈烧瓶,请在d的虚线框内画出所需实验装置图,并标出试剂。
19.试验结束后,将三颈烧瓶中混合物分离开的实验操作是 ;(已知SCl2的沸点为50℃)若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为 (保留三位有效数字)。
20.分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是 。
正确答案
球形冷凝管,吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解。
解析
仪器c是球形冷凝管,f有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。
考查方向
解题思路
f有两个作用一个是防止有毒的氯气与二氧化硫逸出,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。
易错点
氯化亚砜与水反应的方程式书写。
正确答案
MnO2 + 4HCl(浓) 
解析
实验室氯气制备的方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
考查方向
解题思路
实验室氯气制备的方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
易错点
氯化亚砜与水反应的方程式书写。
正确答案
SOCl2+H2O=SO2↑+2HCl↑;AlCl3溶液易水解,AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解。
解析
氯化亚砜与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生。
考查方向
解题思路
AlCl3溶液易水解。
易错点
氯化亚砜与水反应的方程式书写。
正确答案
丁
解析
丁制取二氧化硫比较合理,因为甲中加热亚硫酸氢钠确实会产生二氧化硫,但是同时也会生成水,所以向下倾斜试管自然是不行。乙中,18.4mol/L的硫酸太浓,其中水分过少硫酸任然以分分子形式存在,无法与铜反应制取二氧化硫。乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根而无法得到二氧化硫。丁中反应生成硫酸钾与二氧化硫还有水。
考查方向
解题思路
乙中无论是浓硝酸还是稀硝酸都具有很强的氧化性可以轻易的将亚硫酸钠中的正4价的硫氧化为正6价的硫酸根而无法得到二氧化硫。
易错点
氯化亚砜与水反应的方程式书写。
正确答案
考查方向
易错点
氯化亚砜与水反应的方程式书写。
正确答案
蒸馏;50.0%(7)取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。
解析
已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离。消耗氯气0.04mol,得到氯化亚砜的理论值为0.08mol,即为9.52g,产率为50%.
考查方向
解题思路
已知氯化亚砜沸点为77℃,已知SCl2的沸点为50℃,所以采用分馏的方法即可将之分离。.
易错点
氯化亚砜与水反应的方程式书写。
正确答案
取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。
解析
取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。滴加硝酸酸化是为了除去可能存在的碳酸根离子,碳酸氢根离子与过量的氢氧化钠,而加入足量的硝酸钡溶液是为了除去过量的亚硫酸根离子。
考查方向
解题思路
取少量W溶液于试管中,加入过量 Ba(NO3)2溶液,静置,取上层清液,滴加 HNO3 酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Clˉ。
易错点
氯化亚砜与水反应的方程式书写。
扫码查看完整答案与解析