- 卤素原子结构及其性质的比较
- 共92题
6.下列实验方案能达到实验目的的是( )
正确答案
解析
Na2SiO3饱和溶液中含有水和硅酸钠,要作对比试验来证明是硅酸钠起防火作用,而不是水,故A错误;
滴入指示剂过量会影响滴定终点的判断,使误差变大,故B错误;
C.强酸能和弱酸盐反应生成弱酸,醋酸具有挥发性,所以通过饱和碳酸氢钠溶液除去二氧化碳中含有的醋酸,二氧化碳和苯酚钠反应生成苯酚,所以据此能判断酸性:醋酸>碳酸>苯酚,故C正确.
D.应用浓溴水,稀溴水观察不到白色沉淀,故D错误;
考查方向
解题思路
A.饱和硅酸钠溶液中含有两种物质,要作对比试验才行;
B.指示剂的加入量一般是2~3滴;
C.强酸能和弱酸盐反应生成弱酸,醋酸具有挥发性,
D.苯酚和浓溴水反应生成三溴苯酚沉淀;
易错点
把握物质的性质及反应原理为解答的关键,注意实验的严密性.A项容易忽视验证水的对比试验的严密性,易判断为正确的。
知识点
7.某温度下,向一定体积0.1 mol· L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示。下列说法不正确的是()
正确答案
解析
A、M点和N点溶液中H+和OH-浓度相同,故对H2O的电离抑制程度相同。
B、Q点溶液中,基于点和守恒可知:c(
C、溶液的导电性取决于自由移动的离子浓度,向一定体积0.1 mol· L-1的氨水中逐滴加入等浓度的盐酸,Q点是完全反应,Q点溶液中的单位浓度的离子数量大于M点溶液。
D、
考查方向
解题思路
A、H+和OH-浓度相同对H2O的电离抑制程度相同。
B、电荷守恒。
C、溶液的导电性取决于自由移动的离子浓度。
D、
易错点
H+和OH-浓度相同对H2O的电离抑制程度相同;
知识点
2.能正确表示下列反应的离子方程式是( )
正确答案
解析
A.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2;故A错误;
B.铵根离子、铝离子与氢氧根离子反应的顺序是铝离子先沉淀,铵根离子再和氢氧根离子反应,沉淀再溶解; NH4Al(SO4)2和Ba(OH)2 按1:2反应,氢氧根沉淀铝离子剩余氢氧根离子恰好和铵根离子反应生成一水合氨,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O;故B错误;
C.浓盐酸可以被酸性高锰酸钾溶液氧化,从而影响双氧水还原性的检验,故C错误;
D.次氯酸根离子具有氧化性,亚硫酸氢根离子具有还原性,次氯酸根离子能将亚硫酸根离子氧化,即ClO-+SO2+H2O═SO42-+Cl-+2H+,故D错误;
考查方向
解题思路
A.三价铁具有氧化性能氧化碘离子;
B.氢氧根离子既能和铝离子反应,也能与铵根离子反应;
C.浓盐酸可以被酸性高锰酸钾溶液氧化
D.次氯酸根离子具有氧化性,亚硫酸氢根离子具有还原性,次氯酸根离子能将亚硫酸根离子氧化
易错点
学生易忽视浓盐酸可以被酸性高锰酸钾溶液氧化
知识点
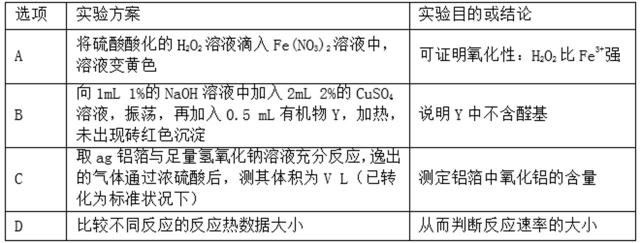
4.下列实验方案能达到实验目的的是( )
正确答案
解析
A.不能排除硝酸根离子的影响,硝酸和双氧水都具有氧化性,混合溶液呈黄色,不能说明氧化剂是双氧水,故A错误
B.新制Cu(OH)2悬浊液氧化醛基需要在碱性条件下,此选项中NaOH的量少,导致氧化没有进行,所以不能验证该有机物结构中是否含有醛基,故B错误;
C.铝和氢氧化钠发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据氢气的体积可确定铝的量,可用测定含量,故C正确;
D.反应热与反应速率没有必要联系,故D错误.
考查方向
解题思路
A.硝酸根离子在酸性条件下具有强氧化性,也可氧化亚铁离子;
B.氢氧化钠量不足
C.根据氢气的体积可确定铝的量;
D.反应热与反应速率没有必要联系
易错点
A项中的硝酸根离子在酸性条件下具有强氧化性为以及B项中新制Cu(OH)2氧化醛基需要在碱性条件下都是学生容易忽视的易错点。
知识点
汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源。德国大众汽车尾气检测造假事件引起全世界震惊。根据下列示意图回答有关问题:

21.汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) ∆H = +180 kJ·mol-1,其能量变化示意图如下:

22.空燃比过小易产生CO。有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。判断该设想是否可行,并说出理由 ▲ 。
23.利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)
24.催化装置中涉及的反应之一为:2NO(g) + 2CO(g)
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图28-1所示的曲线。催化装置比较适合的温度和压强是 ▲ 。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图28-2所示。则前10 s 内,CO和NO百分含量没明显变化的原因是 ▲ 。
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:

正确答案
632;
解析
设NO中氮氧键的键能为x,△H=反应物的键能总和﹣生成物的键能总和=(946+498)kJ•mol﹣1﹣2×x=180kJ•mol﹣1,解得x=632 kJ•mol﹣1,故答案为:632;
考查方向
解题思路
△H=反应物的键能总和﹣生成物的键能总和;
易错点
本题考查较为综合,涉及反应热的计算、反应自发性的判断、化学反应速率和化学平衡的影响因素与图象的关系、平衡常数的计算等知识,为高频考点,其中(4)③是难点,把握控制变量法分析反应速率的影响因素及图象为解答的关键,题目难度较大。
正确答案
不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0;
解析
2CO(g)=2C(s)+O2(g)(△H>0、△S<0)是一个焓增、熵减的反应,任何情况下不能自发进行,所以无法消除CO的污染,故答案为:不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0;
故答案为:5000L•mol﹣1;
考查方向
解题思路
根据△H﹣T△H<0来判断反应的自发性;
易错点
本题考查较为综合,涉及反应热的计算、反应自发性的判断、化学反应速率和化学平衡的影响因素与图象的关系、平衡常数的计算等知识,为高频考点,其中(4)③是难点,把握控制变量法分析反应速率的影响因素及图象为解答的关键,题目难度较大。
正确答案
解析
xC(s)+2NOx(g)⇌N2(g)+xCO2 (g)△H=﹣b kJ•mol﹣1.此反应为放热反应,
A.增加排气管长度,增大了相当于增大了固体的接触面积,加快了化学反应速率,故A正确;
B.增大尾气排放口,对反应速率和平衡不产生影响,故B错误;
C.升高排气管温度,温度升高,平衡左移,不利于NOx转化,故C错误;
D.添加合适的催化剂,加快化学反应速率,故D正确;
故答案为:AD;
考查方向
解题思路
A.增加排气管长度,增大了相当于增大了固体的接触面积,加快了化学反应速率,对平衡无影响;
B.增大尾气排放口,对反应速率和平衡不产生影响;
C.升高排气管温度,温度升高,平衡左移,不利于NOx转化;
D.添加合适的催化剂,加快化学反应速率,对平衡无影响;
易错点
本题考查较为综合,涉及反应热的计算、反应自发性的判断、化学反应速率和化学平衡的影响因素与图象的关系、平衡常数的计算等知识,为高频考点,其中(4)③是难点,把握控制变量法分析反应速率的影响因素及图象为解答的关键,题目难度较大。
正确答案
①400K,1MPa:②尚未达到催化剂工作温度(或尚未达到反应的温度);③5000L•mol﹣1;
解析
①由图2可知,等压条件下,温度越低,NO的转化率越高,因此温度选400K,同温下,NO的转化率随着温度的升高变化不大,所以选用较为经济的1MPa,
故答案为:400K,1MPa:
②汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线变化分析,开始的气体含量变化不大,说明温度低,催化剂的作用未起作用;证明反应未达到催化剂工作温度(或尚未达到反应的温度);
故答案为:尚未达到催化剂工作温度(或尚未达到反应的温度);
③设400K达到平衡状态时,则
2NO(g)+2CO(g)⇌N2(g)+2CO2(g).
初始浓度(10﹣3mol•L﹣1):1 3.60 0 0
转化浓度(10﹣3mol•L﹣1):0.9 0.9 0.45 0.9
平衡浓度(10﹣3mol•L﹣1):0.1 2.7 0.45 0.9
K=
因Ⅰ、Ⅱ温度相同,初始浓度相等,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同,而Ⅲ的温度高,则反应速率最大且平衡逆移,即达到化学平衡时c(NO)增大,实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图为
故答案为:5000L•mol﹣1;
考查方向
解题思路
①综合考虑NO的转化率和成本;
②汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线变化分析,开始的气体含量变化不大,说明温度低,催化剂的作用未起作用;
③结合表格中的浓度,利用三段法列出400K时平衡浓度,带入平衡常数表达式计算;根据外界条件对化学反应速率和化学平衡的影响判断。
易错点
本题考查较为综合,涉及反应热的计算、反应自发性的判断、化学反应速率和化学平衡的影响因素与图象的关系、平衡常数的计算等知识,为高频考点,其中(4)③是难点,把握控制变量法分析反应速率的影响因素及图象为解答的关键,题目难度较大。
扫码查看完整答案与解析