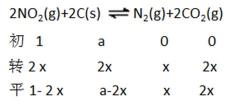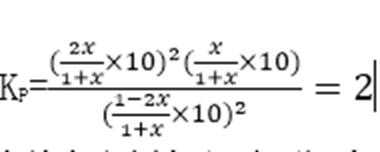- 卤素原子结构及其性质的比较
- 共92题
京津冀环境污染控制国际论坛于2016年4月24日在天津工业大学隆重举行,倡导低碳社会也是一个重要的方面,研究CO2的利用对促进低碳社会的构建具有重要意义,二氧化碳合成甲醇是碳减排的新方向。
19.已知: ① 2H2(g) + O2(g) = 2H2O(g) △H=-484.0 kJ/mol
② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol
③ H2O(g) = H2O(l) △H=-44.0 kJ/mol
请写出甲醇的燃烧热的热化学方程式, 该反应的平衡常数表达式为K= .
20.向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
21.②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的转化率相等
c、CO2和H2的体积分数保持不变
d、混合气体的密度保持不变
e、1mol CO2生成的同时有1mol C-H键断裂
22.③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
23.改变条件,使反应CO2(g)+3H2(g) 
① 达到平衡时,该反应逆反应平衡常数K= 平衡时H2的 转化率是
24.②在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
25.用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极的反应式为________
正确答案
CH3OH (g)+ 3/2O2 (g) =CO2 (g)+2H2O (l) △H=-765kJ/mol K=
解析
① 2H2(g) + O2(g) = 2H2O(g) △H=-484.0 kJ/mol
② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol
③ H2O(g) = H2O(l) △H=-44.0 kJ/mol
根据盖斯定律:②+3/2①+2③可得甲醇的燃烧热的热化学方程式,CH3OH (g)+ 3/2O2 (g) =CO2 (g)+2H2O (l)
△H=-765kJ/mol,该反应的平衡常数表达式为K=
考查方向
解题思路
根据盖斯定律:②+3/2①+2③可得甲醇的燃烧热的热化学方程式;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
低温
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
①由② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol可知:CO2(g)+3H2(g) 
考查方向
解题思路
①△G=△H-T△S,该反应自发进行的条件是△G<0,低温有利于反应的自发进行;
后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡:
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
acd;
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
混合气体的平均式量保持不变,各种气体浓度不变,反应达到平衡状态,正确;
b、CO2和H2的转化率不变,则反应达到平衡状态,CO2和H2的转化率相等,反应未达到平衡状态,错误;
c、CO2和H2的体积分数保持不变,各种气体浓度不变,反应达到平衡状态,正确;
d、反应是体积减小的反应,混合气体的密度保持不变,各种气体浓度不变,反应达到平衡状态,正确;
e、1mol CO2生成的同时有1mol C-H键断裂,反应向逆反应方向进行,反应未达到平衡状态,错误;
故选acd;
考查方向
解题思路
根据化学平衡原理解释;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大一倍,然后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡,t2~t6 CO2的浓度随时间的变化如下图:
考查方向
解题思路
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大一倍,然后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡:
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
① 0.15 50%
解析
改变条件,使反应CO2(g)+3H2(g) 
达到平衡时,该反应逆反应平衡常数
考查方向
解题思路
达到平衡时,该反应逆反应平衡常数
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
② < 不
解析
改变条件,使反应CO2(g)+3H2(g) 

考查方向
解题思路
反应向逆反应方向进行,一定是升高温度,则T1<T2。Qc=0.15=K,则平衡不移动;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
CO2+8e﹣+8H+=CH4+2H2O。
解析
CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e﹣+8H+=CH4+2H2O。
考查方向
解题思路
CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e﹣+8H+=CH4+2H2O。
易错点
本题考查了原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
5. 常温下,下列说法正确的是( )
正确答案
解析
A.分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
B.pH=a的CH3COOH溶液加水稀释10n倍后,稀释过程中醋酸的电离程度增大,则稀释10n倍后,溶液的pH变化小于n,即稀释后溶液的pH<a+n<7,故B错误;
C.pH相等的CH3COONa、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
D.Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
本题正确答案是D
考查方向
解题思路
A.醋酸为弱酸,pH相等时醋酸的浓度较大,消耗的氢氧化钠的物质的量较大;
B.醋酸在稀释过程中电离程度增大,则稀释10n倍后,溶液的pH变化小于n;
C.氢氧化钠抑制了水的电离,醋酸钠水解促进了水的电离;
D.根据碳酸钠溶液中的质子守恒判断
易错点
弱电解质的电离及影响、离子浓度大小比较、溶液pH的计算;
知识点
H2S、SO2在工农业生产中具有重要应用。
14.羰基硫(COS)可作粮食熏蒸剂

①羰基硫的电子式为____________________;
②下列能说明碳与硫两元素非金属性相对强弱的是____________(填序号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
15.H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式______________。
16.H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
②某溶液含0.010 mol·L-1Fe2+、未知浓度的Mn2+和0.10 mol·L-1H2S,当溶液pH=___时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
17.用图所示装置可将SO2转化为重要的化工原料,A、B是惰性电极。则电子流入的电极为_______(用A或B表示),A极的电极反应式为__________________
正确答案
(1)①
解析
(1)①羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为

a.相同条件下水溶液的pH:Na2CO3>Na2SO4,说明碳酸的酸性强于硫酸,碳酸和硫酸为C和S元素的最高价氧化物对应的水化物,则证明非金属性S>C,故a正确;
b.酸性:H2SO3>H2CO3,由于亚硫酸不是S元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故b错误;
c.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故c正确;
故答案为:ac;
考查方向
解题思路
(1)①根据羰基硫分子结构和CO2相似,羰基硫分子中所有原子的最外层都满足8电子结构判断其电子式;
②利用氢化物稳定性、最高价氧化物水化物酸性及得电子能力比较非金属性;
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
正确答案
(2)5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
解析
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,该反应的化学方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案为:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
考查方向
解题思路
(2)由反应物、生成物及电子守恒书写化学反应;
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
正确答案
(3)①0.043 ②2 ③2×106
解析
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=KSP(FeS)时开始沉淀,所以c(S2-)= Ksp(FeS)/c(Fe2+)= 1.4×10-19/0.010mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时Fe2+开始沉淀,故答案为:2;
当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)= Ksp(MnS)/c(Mn2+)= 2.8×10-13/0.010mol/L=2.8×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀。c(Mn2+)/c(Fe2+)=2.8×10-11mol/L /1.4×10-17mol/L=2×106;
考查方向
解题思路
(3)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(FeS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;再一次根据当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,然后求c(Mn2+)/c(Fe2+)即可求出答案。
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
正确答案
(4)B SO2+2H2O-2e-=SO42-+4H+
解析
(4)①由图可知,左侧SO2失去电子转化为SO42-,右侧O2只得到电子,则右侧为正极,A极为负极,电子从A极流出,B为电子流入的一极。由原电池的知识可知,负极发生氧化反应,失去电子,溶液为50% H2SO4,由此可知A极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+。
考查方向
解题思路
(4)由图可知,右侧O2得到电子,则右侧为正极,A极为负极,电子从A极流出.由原电池的知识可知,负极发生氧化反应,失去电子,再根据溶液的酸碱性即可写出电极方程式。
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃刹。
18.肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因_________________________。
19.已知:2 N2H4 (1)+ N2O4 (1)===3N2(g)+4H2O(1) △H=-1225 kJ·mol-1
断开1 mol下列化学键吸收的能量分
则使1 mol N2O4 (1)分子中化学键完全断裂时需要吸收的能量是_________________
20.已知N2O4 (1)

②前10 min内用NO2表示的反应速率为_____,20 min时改变的条件是_____;重新达到平衡时,NO2的百分含量 _________(填序号)a.增大 b.减小 C.不变 d.无法判断
21.已知:在相同条件下N2H4·H2O的电离程度大于
N2H5C1的水解程度。常温下,若将0.2 mo1·L-1N2H4·H2O溶液与0.1 mol·L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为_____________。
正确答案
(1)N2H4+H2O⇌N2H+5+OH-
解析
(1)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O⇌N2H+5+OH-;故答案为:N2H4+H2O⇌N2H+5+OH-;
考查方向
解题思路
(1)N2H4结合H2O电离的氢离子使溶液呈碱性;
易错点
等效平衡的建立及离子浓度大小的比较。
正确答案
(2)1793kJ
解析
(2)设1mol N2O4(1)完全分解成相应的原子时需要吸收的能量QKJ,则:190kJ/mol×2+390kJ/mol×8+QkJ/mol-946kJ/mol×3-460kJ/mol×8=-1225 kJ/mol,解得Q=1793,故答案为:1793kJ;
考查方向
解题思路
(2)反应热=反应物总键能-生成物总键能;
易错点
等效平衡的建立及离子浓度大小的比较。
正确答案
(3)①NO2 0.9
②0.04mol/(L.min) 向容器中加入0.8molNO2 b
解析
(3)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,10min时到达平衡,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;平衡常数K=c2(NO2)/c(N2O4)=0.62/0.4=0.9;
②v(NO2)=(0.6mol/L-0.2mol/L)/10min=0.04mol/(L.min);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小,故答案为:0.04mol/(L.min);向容器中加入0.8molNO2;b;
考查方向
解题思路
(3)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,前10min内,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;平衡常数K=c2(NO2)/c(N2O4),代入物质的浓度计算;②根据v=△c/△t,计算v(NO2);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小;
易错点
等效平衡的建立及离子浓度大小的比较。
正确答案
(4)c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
解析
(4)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
考查方向
解题思路
(4)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
易错点
等效平衡的建立及离子浓度大小的比较。
7.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
正确答案
解析
从文字叙述可以看出是从浓酒中分离出乙醇,是利用酒精与水的沸点不同,用蒸馏的方法将其分离提纯,因此答案选择C。
考查方向
解题思路
把握关键的信息,排除干扰。
易错点
借用古籍记载,学生阅读时不理解其中的意义。
知识点
氮的化合物在生产生活中广泛存在。
25.①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
26.用焦炭还原NO的反应为:2NO(g)+C(s)
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
27.用焦炭还原NO2的反应为:2NO2(g)+2C(s)
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
正确答案
① ;+11.3 kJ•mol-1②NH2Cl+H2O NH3+HClO
解析
①氯胺为共价化合物电子式为: 。反应热=反应物的总键能-生成物的总键能:
即ΔH=[391.3×3+243-(391.3×2+191.2)-431.8]KJ.mol^(-1)=11.3 KJ.mol^(-1)
②由信息可知NH2Cl与水反应生成强氧化性的物质为HClO,反应式为NH2Cl+H2O NH3+HClO
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①放热;②0.003 mol•L-1•min-1。
解析
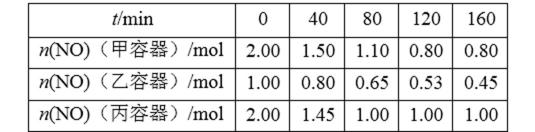
对比图表数据中的甲与丙,在起始物相同时,丙建立平衡的时间短,由此说明,丙的反应温度更高,反应速度更快。再对比建立平衡后甲容器中NO的量更低,说明低温更有利于NO的转化,因此该反应为放热反应。
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
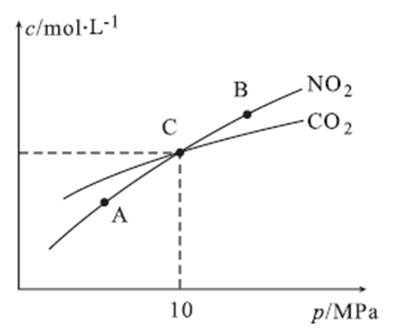
①=(1分) ②A
③2 MPa
解析
①A、B两点温度相同,所以Kc(A)=Kc(B)
②因为2NO2(g)+2C(s)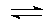
③在C点c(NO2)=c(CO2)即1-2x=2x,可计数出x=0.25mol,
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
回答下列问题:
28.A的名称是 ;已知C是反式产物,则C的结构简式为 。
29.⑥的反应类型是 ,⑧的反应类型是 。
30.F含有的官能团的名称是 。
31.反应⑤的化学方程式为 。
32.肉桂酸(
33.参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯
(
正确答案
乙炔
解析
由A的分子为C2H2,所以A为乙炔。B的结构简式为:

考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
加成反应;氧化反应。
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
碳碳双键;羟基
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
7种;CH3CH2OCH2CH3
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
1.《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行与世”的描述,对上文进行的某些分析中正确的是()
正确答案
解析
由题中所给信息可知,“洧水”就是石油。
A.“洧水”的主要成分是石油,石油是各种烃的混合物,而油脂是油和脂肪的简称。
B.“洧水”的主要成分是石油,煤油在自然界很难找到。故B错误。
C.石油中含碳量较高,燃烧不充分,所以产生较浓的烟。烟的主要成分为因未充分燃烧而产生的炭黑。故C正确。
D.烟的主要成分碳的颗粒,不是石墨,故D错误。
考查方向
解题思路
本题中“洧水”主要成分为石油,根据石油性质进行解题即可。
易错点
混淆烃和酯的概念。
知识点
2.分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是()
正确答案
解析
A.分枝酸分子中含有-COOH,可与醇发生酯化反应,-OH可以与羧酸发生酯化反应。故反应类型均为酯化反应,反应类型相同。故A正确。
B.1 mo1分枝酸最多可与2 mol NaOH发生中和反应。分枝酸分子中的环不是苯环,羟基不是酚羟基,而是醇羟基,不能与NaOH发生中和反应。所以2个羧基最多能2 mol NaOH发生中和反应,不是3mol NaOH。故B错误。
C.根据结构简式确定分枝酸分子的分子式为C10H10O6。故C错误。
D.分枝酸分子中含有羧基、醇羟基、双键、醚键4种官能团。故D错误。
考查方向
解题思路
掌握有机物中各官能团与性质的关系是解题的关键。
易错点
将醇羟基当成了酚羟基,误选B选项。
知识点
7. 有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:2SO2+O2 
正确答案
解析
起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图示),反应为:2SO3 
A容器在体积增大的过程中,浓度降低,反应速率降低,故达到平衡所需时间比容器B长(选项A错误)。
均达到平衡后,向两容器中分别通入等量的氦气,恒压容器A的体积增大,导致平衡又向生成SO2+O2的方向移动,A中SO3的体积分数减少(选项D错误),恒容容器B中平衡不移动、SO3的体积分数不变。
考查方向
解题思路
依据恒温恒压、恒温恒容时平衡移动规律解题。
易错点
易错选A或D。
知识点
扫码查看完整答案与解析