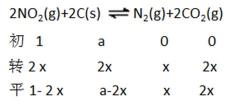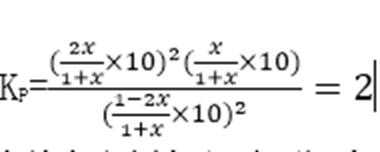- 卤素原子结构及其性质的比较
- 共92题
京津冀环境污染控制国际论坛于2016年4月24日在天津工业大学隆重举行,倡导低碳社会也是一个重要的方面,研究CO2的利用对促进低碳社会的构建具有重要意义,二氧化碳合成甲醇是碳减排的新方向。
19.已知: ① 2H2(g) + O2(g) = 2H2O(g) △H=-484.0 kJ/mol
② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol
③ H2O(g) = H2O(l) △H=-44.0 kJ/mol
请写出甲醇的燃烧热的热化学方程式, 该反应的平衡常数表达式为K= .
20.向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
21.②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的转化率相等
c、CO2和H2的体积分数保持不变
d、混合气体的密度保持不变
e、1mol CO2生成的同时有1mol C-H键断裂
22.③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
23.改变条件,使反应CO2(g)+3H2(g) 
① 达到平衡时,该反应逆反应平衡常数K= 平衡时H2的 转化率是
24.②在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
25.用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极的反应式为________
正确答案
CH3OH (g)+ 3/2O2 (g) =CO2 (g)+2H2O (l) △H=-765kJ/mol K=
解析
① 2H2(g) + O2(g) = 2H2O(g) △H=-484.0 kJ/mol
② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol
③ H2O(g) = H2O(l) △H=-44.0 kJ/mol
根据盖斯定律:②+3/2①+2③可得甲醇的燃烧热的热化学方程式,CH3OH (g)+ 3/2O2 (g) =CO2 (g)+2H2O (l)
△H=-765kJ/mol,该反应的平衡常数表达式为K=
考查方向
解题思路
根据盖斯定律:②+3/2①+2③可得甲醇的燃烧热的热化学方程式;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
低温
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
①由② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol可知:CO2(g)+3H2(g) 
考查方向
解题思路
①△G=△H-T△S,该反应自发进行的条件是△G<0,低温有利于反应的自发进行;
后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡:
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
acd;
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
混合气体的平均式量保持不变,各种气体浓度不变,反应达到平衡状态,正确;
b、CO2和H2的转化率不变,则反应达到平衡状态,CO2和H2的转化率相等,反应未达到平衡状态,错误;
c、CO2和H2的体积分数保持不变,各种气体浓度不变,反应达到平衡状态,正确;
d、反应是体积减小的反应,混合气体的密度保持不变,各种气体浓度不变,反应达到平衡状态,正确;
e、1mol CO2生成的同时有1mol C-H键断裂,反应向逆反应方向进行,反应未达到平衡状态,错误;
故选acd;
考查方向
解题思路
根据化学平衡原理解释;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大一倍,然后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡,t2~t6 CO2的浓度随时间的变化如下图:
考查方向
解题思路
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大一倍,然后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡:
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
① 0.15 50%
解析
改变条件,使反应CO2(g)+3H2(g) 
达到平衡时,该反应逆反应平衡常数
考查方向
解题思路
达到平衡时,该反应逆反应平衡常数
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
② < 不
解析
改变条件,使反应CO2(g)+3H2(g) 

考查方向
解题思路
反应向逆反应方向进行,一定是升高温度,则T1<T2。Qc=0.15=K,则平衡不移动;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
CO2+8e﹣+8H+=CH4+2H2O。
解析
CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e﹣+8H+=CH4+2H2O。
考查方向
解题思路
CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e﹣+8H+=CH4+2H2O。
易错点
本题考查了原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
5. 常温下,下列说法正确的是( )
正确答案
解析
A.分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
B.pH=a的CH3COOH溶液加水稀释10n倍后,稀释过程中醋酸的电离程度增大,则稀释10n倍后,溶液的pH变化小于n,即稀释后溶液的pH<a+n<7,故B错误;
C.pH相等的CH3COONa、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
D.Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
本题正确答案是D
考查方向
解题思路
A.醋酸为弱酸,pH相等时醋酸的浓度较大,消耗的氢氧化钠的物质的量较大;
B.醋酸在稀释过程中电离程度增大,则稀释10n倍后,溶液的pH变化小于n;
C.氢氧化钠抑制了水的电离,醋酸钠水解促进了水的电离;
D.根据碳酸钠溶液中的质子守恒判断
易错点
弱电解质的电离及影响、离子浓度大小比较、溶液pH的计算;
知识点
7.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
正确答案
解析
从文字叙述可以看出是从浓酒中分离出乙醇,是利用酒精与水的沸点不同,用蒸馏的方法将其分离提纯,因此答案选择C。
考查方向
解题思路
把握关键的信息,排除干扰。
易错点
借用古籍记载,学生阅读时不理解其中的意义。
知识点
氮的化合物在生产生活中广泛存在。
25.①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
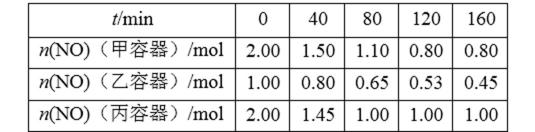
26.用焦炭还原NO的反应为:2NO(g)+C(s)
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
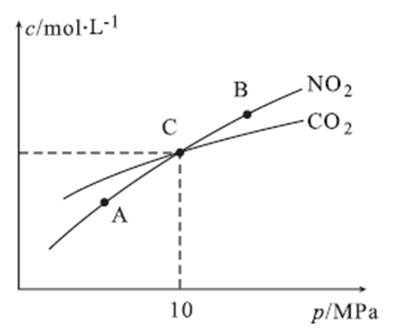
27.用焦炭还原NO2的反应为:2NO2(g)+2C(s)
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
正确答案
① ;+11.3 kJ•mol-1②NH2Cl+H2O NH3+HClO
解析
①氯胺为共价化合物电子式为: 。反应热=反应物的总键能-生成物的总键能:
即ΔH=[391.3×3+243-(391.3×2+191.2)-431.8]KJ.mol^(-1)=11.3 KJ.mol^(-1)
②由信息可知NH2Cl与水反应生成强氧化性的物质为HClO,反应式为NH2Cl+H2O NH3+HClO
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①放热;②0.003 mol•L-1•min-1。
解析
对比图表数据中的甲与丙,在起始物相同时,丙建立平衡的时间短,由此说明,丙的反应温度更高,反应速度更快。再对比建立平衡后甲容器中NO的量更低,说明低温更有利于NO的转化,因此该反应为放热反应。
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①=(1分) ②A
③2 MPa
解析
①A、B两点温度相同,所以Kc(A)=Kc(B)
②因为2NO2(g)+2C(s)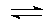
③在C点c(NO2)=c(CO2)即1-2x=2x,可计数出x=0.25mol,
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
回答下列问题:
28.A的名称是 ;已知C是反式产物,则C的结构简式为 。
29.⑥的反应类型是 ,⑧的反应类型是 。
30.F含有的官能团的名称是 。
31.反应⑤的化学方程式为 。
32.肉桂酸(
33.参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯
(
正确答案
乙炔
解析
由A的分子为C2H2,所以A为乙炔。B的结构简式为:

考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
加成反应;氧化反应。
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
碳碳双键;羟基
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
7种;CH3CH2OCH2CH3
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
扫码查看完整答案与解析