- 卤素原子结构及其性质的比较
- 共92题
奎尼丁对下述哪一种心律失常无效
A.窦性心动过速
B.心房扑动
C.室性早搏
D.房性早搏
E.房室交界区的早搏
正确答案
A
解析
暂无解析
5.下列实验误差分析错误的是
正确答案
解析
A.湿润的pH值试纸可以稀释碱液,溶液中氢氧根离子浓度减小,测定的溶液碱性减弱,测定值偏小,故A正确;
B.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积,会导致所测溶液体积偏小,故B正确;
C.定容时俯视刻度线,导致所配溶液的体积偏小,结合
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故D正确;
考查方向
本题考查化学实验方案的评价
解题思路
A.湿润的pH值试纸可以稀释碱液;
B.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积;
C.定容时俯视刻度线,导致所配溶液的体积偏小,结合
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大
易错点
B、C项中的误差分析
教师点评
本题考查化学实验方案的评价,在近几年的各省高考题中出现的频率非常高,常与化学实验基本操作、仪器的使用、沉淀的生成与转化、酸性比较、非金属性比较、氧化还原反应等知识点交汇命题
知识点
硝酸铝是一种常用皮革鞣剂。工业上用铝灰(主要合Al、A12O3、Fe2O3等)制取硝酸铝晶体
的流程如下:
完成下列填空:
40.用NaOH固体配制30%的NaOH溶液
41.反应Ⅱ中为避免铝的损失,需要解决的问题是 。
42.从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:
减压蒸发、 、过滤、 、低温烘干。
43.有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因 。
44.某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:

调节pH的目的是 。
为使得到的硝酸铝晶体较纯净,所用的X物质可以是 (填编号)。A.氨水 B.铝 C.氢氧化铝 D.偏铝酸钠
45.该实验室制法与工业上制法相比,其缺点是 。
46.称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,
计算
正确答案
解析
用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,还需要量筒
考查方向
本题考查溶液的配制
解题思路
用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
易错点
质量百分比浓度与物质的量浓度溶液的配制方法区别
教师点评
本题考查溶液的配制,在近几年的各省高考题中出现的频率较高,常与一定物质的量浓度溶液的配制等知识交汇命题
正确答案
如何控制反应终点(或硝酸的用量)
解析
硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,需要解决的问题是:如何控制反应终点(或硝酸的用量),可以将加入稀硝酸改为通入过量CO2,避免氢氧化铝沉淀溶解
考查方向
本题考查实验制备方案
解题思路
反应Ⅰ:铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,
反应Ⅱ:滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失
易错点
对工艺流程的理解、分析
教师点评
本题考查实验制备方案,在近几年的各省高考题中出现的频率较高,常与物质的分离等知识点交汇命题
正确答案
冷却结晶 洗涤
解析
从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干
考查方向
本题考查物质的分离提纯
解题思路
反应Ⅲ:氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体
易错点
过滤后要经过洗涤操作
教师点评
本题考查物质的分离提纯,在近几年的各省高考题中出现的频率非常高,题目难度不大
正确答案
产物中,杂质NaN03的含量较高或后续的蒸发浓缩能耗高
解析
反应Ⅱ、Ⅲ合并以简化操作,产物中杂质NaNO3的含量较高
考查方向
本题考查实验方案的分析与评价
解题思路
产物中杂质NaNO3的含量较高
易错点
反应Ⅱ、Ⅲ的目的
教师点评
本题考查实验方案的分析与评价,在近几年的各省高考题中出现的频率非常高,常与物质的性质、制备实验和性质实验等等知识点交汇命题
正确答案
将Fe3+转化为Fe(OH)3沉淀除去 (1分) BC(2分)
解析
铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,加入的X能与酸反应且不能引入新杂质,故不能选氨水、偏铝酸钠,可以选择Al与氢氧化铝
考查方向
本题考查实验制备方案
解题思路
铝灰用稀硝酸溶解,Al、A12O3、Fe2O3均反应得到硝酸铝、硝酸铁,加入X调节pH使铁离子转化为氢氧化铁沉淀,过滤除去,加入的X能与酸反应切不能引入新杂质
易错点
调节pH时不能引入新杂质
教师点评
本题考查实验制备方案,在近几年的各省高考题中出现的频率非常高,常与物质的性质、制备实验和性质实验等等知识点交汇命题
正确答案
产生大量污
解析
Al与稀硝酸反应会生成NO,污染空气
考查方向
本题考查实验方案的评价
解题思路
反应会生成NO,污染空气
易错点
评价方案要从环保,原材料的消耗量等角度分析
教师点评
本题考查实验方案的评价,在近几年的各省高考题中出现的频率非常高,常与物质的性质、制备实验和性质实验等等知识点交汇命题
正确答案
8.7
解析
根据Al元素守恒
2Al(NO3)3·nH2O ~ Al2O3
2(213+18n) 102
7.392 1.020
解得:n=8.7
考查方向
本题考查结晶水的定量计算
解题思路
利用加热分解过程中的Al守恒
易错点
利用Al的守恒法
教师点评
本题考查结晶水的定量计算,在近几年的各省高考题中出现的频率非常高,题目难度中等
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
15.古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是 (填字母
序号)。 a. Fe b. FeO c. Fe3O4 d. Fe2O3
16.现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
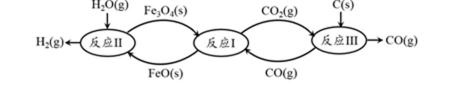



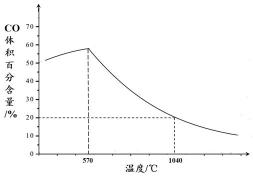
铁氧化物循环裂解水制氢气总反应的热化学方程式是 。 ② 下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
应Fe3O4(s) + 4CO(g) 
由是 。 ii. 随温度升高,反应Fe3O4(s) + CO(g) 
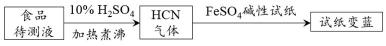
17.① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是 。② 如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用 。
正确答案
c
解析
天然磁石成分为四氧化三铁;
考查方向
本题考查了铁及其氧化物的知识点。
解题思路
古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁。
易错点
磁铁成分主要是四氧化三铁,铁锈成分主要是氧化铁。
教师点评
本题考查了铁及其氧化物的知识点,在近几年的各省高考题出现的频率较高。
正确答案
① C(s) + H2O(g) === H2(g) + CO(g) ΔH == + 134.5 kJ·mol-1 ② i. < (1分)
理由:当其他条件一定时,温度升高,CO的体积百分含量增大,
可逆反应Fe3O4(s)+4CO(g)
解析
①Ⅰ.Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)⇌2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ,
故答案为:C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ;
②i.当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行,图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应,△H<0,
故答案为:<;当其他条件一定时,温度升高,CO的体积百分含量增大,可逆反应Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g) 逆向移动,故△H<0;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1040℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
(1−x)
x=0.8mol/L
K=0.81−0.8=4,
故答案为:增大; 4;
考查方向
本题考查了热化学方程式,反应热,焓变和化学平衡的计算等知识点。
解题思路
①Ⅰ.Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)⇌2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;
②i.图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,结合三行计算列式计算得到平衡浓度,平衡常数K=生成物平衡难度幂次方乘积
;
易错点
注意热化学方程式的书写。
教师点评
本题考查了热化学方程式,反应热,焓变和化学平衡的计算等知识点,在近几年的各省高考题出现的频率非常高。
正确答案
① 3[Fe(CN)6]4- + 4Fe3+ === Fe4[Fe(CN)6]3↓②
碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+; [Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色。
解析
①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓,
故答案为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-
与Fe3+反应生成普鲁士蓝使试纸显蓝色,
故答案为:碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-
与Fe3+反应生成普鲁士蓝使试纸显蓝色.
考查方向
本题考查了离子检验实验设计方案分析判断的知识点
解题思路
①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀;
②若试纸变蓝则证明食品中含有CN-,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4-
与Fe3+反应生成普鲁士蓝使试纸显蓝色.
易错点
注意题干信息的运用。
教师点评
本题考查了离子检验实验设计方案分析判断的知识点,在近几年的各省高考题出现的频率较高。
8.下列装置能达到实验目的的是
正确答案
解析
见解题思路。
考查方向
本题考查化学实验装置科学性和可行性。
解题思路
选项A:错误。由于进入右侧高锰酸钾酸性溶液的气体除了乙烯之外,还有乙醇气体,也能使高锰酸钾溶液褪色。
选项B:错误。应该将混合气体通过灼热的碳粉。
选项C:正确。当把氢氧化钠快速推入烧瓶中的时候,CO2气体被吸收,烧瓶中气压下降,导致水蒸气的沸点也下降,因此在不足100℃时也会被蒸馏出来。
选项D:错误。因为氨气极易溶于水,一体积水可以溶解700体积的氨气.即使是饱和的氯化铵溶液也含有很多水,依然可以吸收氨气.
易错点
A选项:学生容易忽略反应物中乙醇也会挥发,也会使高锰酸钾酸性溶液褪色。
D选项:虽然氯化铵溶液中的NH4+会对NH3溶于水产生抑制作用,但是由于氨气在水中的溶解度太大,因而氨气依然会溶于水。
教师点评
本题考查化学实验装置的科学性和可行性,在各省近几年的高考题中出现概率较高。常与元素化合物、化学平衡移动原理、有机化学等知识点交汇命题。
知识点
扫码查看完整答案与解析