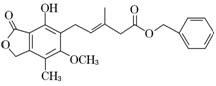- 氢键的存在对物质性质的影响
- 共39题
20.电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电—锂碘电池的材料。该电池反应如下:
则△H=_____________________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。请回答下列问题:
①直流电的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
正确答案
(1)
(2)①B
②
③不变 7.2
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。
36. [选修2—化学与技术]略
37. [选修3—物质结构与性质]
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有_________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子


(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为________________________
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________________
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为________________________
(7)X单质的晶胞如右图所示,一个X晶胞中有________________个X原子;若X晶体的密度为

38.[选修5—有机化学基础]
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与


请回答:
(1)B、F的结构简式分别为____________、____________
(2)反应①〜⑦中,属于消去反应的是________ (填反应序号)。
(3)D发生银镜反应的化学方程式为_______________________;反应⑦的化学方程式为________________________
(4)A的相对分子质量在180〜260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为________________________________________
(5)符合下列条件的F的同,分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
36.请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。36. [选修2—化学与技术]略37. [选修3—物质结构与性质]
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有_________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类 型为________________
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为________________________
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________________
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为________________________
(7)X单质的晶胞如右图所示,一个X晶胞中有________________个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为________cm(用代数式表示)
38. [选修5—有机化学基础]
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。
请回答:
(1)B、F的结构简式分别为____________、____________
(2)反应①〜⑦中,属于消去反应的是________ (填反应序号)。
(3)D发生银镜反应的化学方程式为_______________________;反应⑦的化学方程式为________________________
(4) A的相对分子质量在180〜260之间,从以上转化中不能确认A中的某一官能团,确 定该官能团的实验步骤和现象为________________________________________
(5)符合下列条件的F的同,分异构体共有________种。
a.能发生银镜反应 b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
37.【选修3-物质结构与性质】
(1)7 (1分) 7(1分)
(2)C<O<N(1分,写成C O N不写“<”可给分;写成N>O>C 可给分,但只写成N O C而不写“>”不能给分=
(3)sp杂化(1分) 4 (1分) 正四面体形、V形(或折线形等合理答案即可)(共2分,各1分)
(4)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2> NaF,故MgF2的熔点比NaF高。(2分,答案要包括两个要点,一为晶体类型不同,熔点不同;二为同种晶体,晶格能大熔点高。)
(5)Cu2++2 NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3 = [Cu(NH3)4]2+ +2OH- (2分,每个方程式各1分)
(6)8 (2分)

正确答案
36.【选修2-化学与技术】略
正确答案
38.【选修4-有机化学基础】

(2)④(1分)
(3)(3分)
(3分)
(4)取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子。(2分)
(5)2(2分)
正确答案
10.有关下图所示化合物的说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. 汽车尾气是造成天气雾霾的重要原因。已知:
①N2(g)+O2(g)

③CO2(g)

请完成以下问题:
(1)请根据反应①②③,确定反应④中ΔH4=( )。
(2)根据图1,反应④的热化学方程式为:( )。
该反应在( )(填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(3)图2表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为:( ), X、Y、Z三点,CO的转化率由大到小的顺序是( )。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K=( )。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01 mol/L、a mol/L、0.01 mol/L、0.04 mol/L,要使反应向正方向进行,a的取值范围为( )。
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线。
正确答案
(1)ΔH4 =-ΔH1-2ΔH3
(2)2CO(g)+2NO(g)
(3)
①Kw>Ky=Kz Z>Y>X
②K=1600 a>0.01
(4)
解析
解析已在路上飞奔,马上就到!
知识点
17.已知反应:
①Cl2 + 2KBr = 2KCl + Br2;
②KClO3 + 6HCl = 3Cl2↑+ KCl + 3H2O;
③2KBrO3 + Cl2 = Br2 +2KClO3
下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析