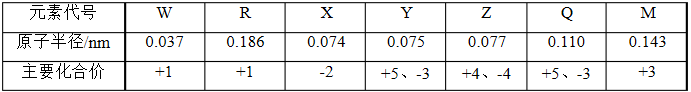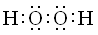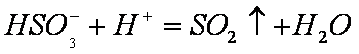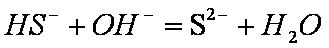- 元素周期律的应用
- 共230题
下表是部分短周期元素的原子半径和主要化合价。
用化学用语回答:
(1)七种元素中原子半径最大的元素在周期表中的位置 ,M的单质与R的最高价氧化物对应的水化物发生反应的化学方程式为 。
(2)X可与R按1:1的原子个数比形成化合物甲,甲中存在的化学键类型有 ,X可与W组成含18电子的化合物乙,则乙的电子式为 。
(3)Y的氢化物比Q的氢化物稳定的根本原因 。
正确答案
见解析。
解析
(1)第三周期 ⅠA族
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)离子键、共价键或非极性共价键
(3)氮的非金属性比磷的强
知识点
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(2)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(3)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(4)下列能用作f和g元素非金属性强弱比较的判断依据的是
A,单质熔点:
B,最高价氧化物对应水化物的酸性:
C,最高价氧化物对应水化物的溶解性:
D,f不能与氢气反应,g能与氢气反应
正确答案
(1) 2s22p3 3
(2)HClO4 KOH + Al(OH)3 →KAlO2 +2H2O
(3) S2― >Cl― >K+ F― +H2O 
(4)BD
解析
略
知识点
已知短周期元素的四种离子:aA2+、bB+、cC3-、dD—都具有相同的电子层结构,则下列叙述中正确的是
正确答案
解析
略
知识点
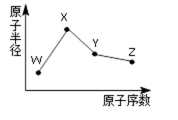
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右下图。已知W
的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是
一种常见的半导体材料;Z的非金属性在同周期元素 中最强。下列说法正确的是
正确答案
解析
略
知识点
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
正确答案
解析
略
知识点
在构成宇宙万物的一百多种元素中,金属约占了80%,它们在现代工业和新材料、新技术研究中具有至关重要的意义。现有a、b、c、d四种金属元素,a是人体内含量最多的金属元素,b是地壳中含量最多的金属元素,c是海水中含量最多的金属元素,d是人类冶炼最多的金属元素。
(1)元素a在元素周期表中的位置为 ;a原子的核外能量不同的电子有 种。
(2)下列可以证明b、c金属性强弱的是 。
A,最高价氧化物对应水化物的溶解性:b
B,单质与水反应的剧烈程度:b
C,相同条件下,氯化物水溶液的pH值:b
D,c可以从b的氯化物水溶液中置换出b
(3)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是 。
A,腐蚀过程中,一定会有气体放出
B,腐蚀过程中,水膜的碱性会增强
C,在酸性条件下,负极的电极反应式为:
D,与电源的负极相连,可以防止发生这种腐蚀
(4)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式: 。
正确答案
(1) 第四周期ⅡA族 ) 6种
(2) BC
(3) BD
(4)3Fe (s) + 4H2O (g) → Fe3O4 (s) +4H2 (g) +150.72kJ
解析
略
知识点
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2/3;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大。下列说法正确的是
正确答案
解析
略。
知识点
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是
正确答案
解析
略。
知识点
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B在元素周期表中的位置 ,写出E2D的电子式 。
(2)写出A与D形成的10电子阳离子的化学式 。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是 。
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式 。
正确答案
见解析。
解析
(1) 第二周期 ⅣA族
(2) H3O+
(3) S2->Cl->Na+
(4) H2(g) + 1/2O2(g) === H2O(l) △H=-286kJ·mol-1
知识点
A、B、C、D、E五种短周期元索,它们的原子序数 依次增大;A元素是所有原子中半径最小的原子;B元索的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)C和E两元索相比较,非金属性较强的是________(填“元素名称”),可以验证该结论的是________(填“序号”)。
A. 比较这两种元索的气态氢化物的沸点
B. 比较这两种元索的单质在常温下的状态
C. 比较这两种元索的气态氢化物的稳定性
D. 比较这两种元素的单质与氢气化合的难易
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为________。
(3)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,该两种化合物反应的化学方程式为________。
(4)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为________。
(5)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为________。
(6)B元素的气态氢化物和其一种常见氧化物(双原于分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为________。
正确答案
(1)氧;CD
(2)
(3)Na2O2+SO2=Na2SO4
(4)
(5)
(6)2:3
解析
略。
知识点
扫码查看完整答案与解析