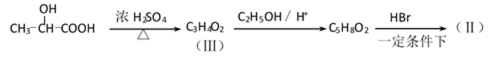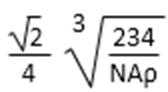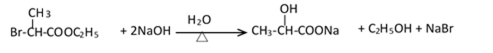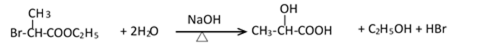- 元素周期律的应用
- 共230题
27.A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下阁为相互转 化关系:
谘回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
(2)写出工业上制取A反应的离子方程式_______________
(3)戊的分子式为_______.B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________
(5)8gE在A中燃烧放山热摄QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
正确答案
见解析。
解析
(1)
(2)
(3)HClO ;
(4)
(5)
(6)向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉。
知识点
13. Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是()
正确答案
解析
略
知识点
13.Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是()
正确答案
解析
略
知识点
10.短周期元素X、Y、Z、R在周期表中的位置如图。下列说法正确的是()
正确答案
解析
略
知识点
请考生从给出的3道化学题中任选一题做答。
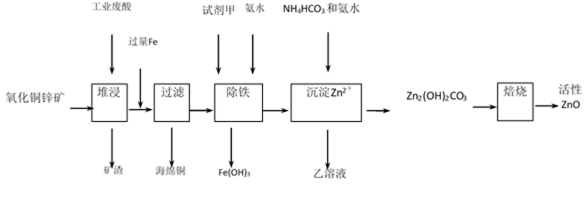
36.某工厂利用工业废酸(10%H2SO4)堆浸某废弃的氧化铜锌矿制取活性ZnO, 方案如下:
已知:298K时各离子开始沉淀及完全沉淀时的pH:
(1) 氧化铜锌矿中含有少量CuS和ZnS,在稀H2SO4作用下ZnS可溶而CuS不溶,这是由于同温下Ksp (ZnS) _________Ksp (CuS)(">" “<”,或“=”)。
(2) 在除铁过程中选用下列试剂中的_________作为试剂甲最合适:
A. Cl2
B. HNO3
C. KMnO4
D. H2O2
(3) 除铁过程中加入氨水的目的 ___________ ,实验中PH应控制的范围 ___________ ;
(4) 加试剂甲后,Fe3+,与氨水生成Fe(OH)3的离子方程式 ___________ ;
(5) 298K时,检验乙溶液中是否残留较多Fe3+的方法 ___________ ;
(6)乙的溶液可直接用作氮肥,乙的化学式 ___________;
(7) Zn2(OH)2CO3焙烧的化学方程式 ___________。
37.已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子云相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)己知A元素扣一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)己知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。
四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
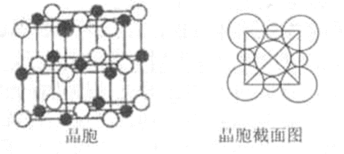
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构, 它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。
若晶体密度为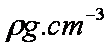
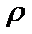
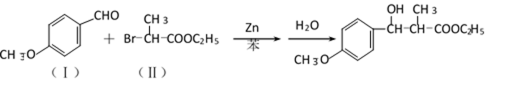
38.有机合成中增长碳链是一个重要环节。如下列反应:
用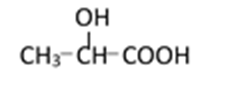
(1)(Ⅰ)的分子式为___________;(Ⅲ)的结构简式为___________ 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为___________ 。
(3)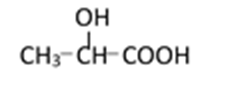
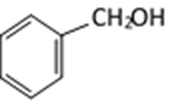
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。(Ⅳ)的结构简式为 ___________。
正确答案
见解析。
解析
36.(1)>
(2) D
(3)调节溶液的pH,使Fe3+沉淀完全, 3.2~6.2
(4)Fe3++3NH3·H2O === Fe(OH)3↓+3 NH4+
(5)取少量乙溶液于试管中,滴入几滴KSCN溶液,若出现红色,说明还有较多Fe3+,若无红色出现,说明Fe3+沉淀完全 ,
(6)(NH4)2SO4
(7)Zn2(OH)2CO3 == 2ZnO+CO2↑ + H2O
37.(1)[Ar]3ds1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na,NaOH > H3PO4 >HClO4>H2SO4
(5)12;
38.(1)C8H8O2 ;CH2=CH-COOH
(2)
或
(3) 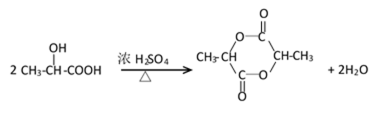
取代反应(或酯化反应)
(4) 
知识点
扫码查看完整答案与解析