- 元素周期律
- 共415题
11. 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢 化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓 溶液。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.A、B、C、D、E、F为短周期元素,且原子序数依次增大,前5种元素质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等。下列说法中不正确的是( )
正确答案
解析
元素推断:A、B、C、D、E为短周期元素,且原子序数依次增大,且A、c能形成两种液态化合物A 2 c和A 2 c 2 知A为H,c为O;A、D同主族,D的原子序数大于氧

A.F和D是同一周期元素,原子序数大于D,则原子半径:r(D)> r(F)> r(A),A正确;
B.D与C也能形成D2C和D2C2化合物,即氧化钠和过氧化钠,两种化合物中阳离子和阴离子个数比都为2:1,B正确;
C.把2mol D的单质投入足量的水中,产生1mol氢气,但气体体积不一定为22.4L,C错误;
D.由A、B、c三种元素组成的18电子微粒:即H、C、O,三者电子数分别为1、6、8,加起来为15,只能再加三个氢原子,即18电子微粒应该为CH 4 O,也就是甲醇。甲醇能发生氧化反应,D正确,答案选C。
考查方向
解题思路
本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
易错点
1、B中过氧根属于原子团其离子数为1 。
2、18电子微粒。
知识点
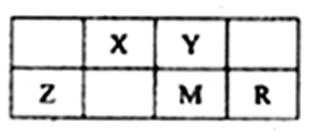
10.五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
正确答案
解析
A. 非金属性,N> P>C ,不正确。B.半径越小,氢化物越稳定,R > M。C. 做光导纤维的是二氧化硅。D. 半径越小,非金属性越强,最高价氧化物对应的水化物酸性越强,故D正确。
考查方向
解题思路
先根据题干推出各元素,在灵活运用元素周期律。最先推出R元素,为S,然后根据,在周期表的位置,分别推出X:C Y:N Z:Al M:P。
易错点
1、元素周期律的表达方式。
2、短周期中各元素在周期表中的位置。
知识点
17.已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,正确的是(甲)XO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MC
正确答案
解析
①n=1,XO3n中X元素为+5价,常见非金属元素中呈+5价的元素有第ⅤA族(氮、磷)、第ⅤⅡA族(氯、溴、碘)所以符合条件的酸根阴离子主要有:IO3-、ClO3-、BrO3-、NO3-,甲反应为ClO3-+5Cl-+6H+=3Cl2+3H2O,IO3-+5I-+6H+=3I2+3H2O,故①错误;
②n=2,XO3n中X元素为+4价,常见非金属元素中碳、硅、硫有+4价,结合通式只有X为硫符合题意,离子方程式为:SO32-+2S2-+6H+=3S↓+3H2O,硫的最高价含氧酸为硫酸,氢化物为硫化氢,故②正确;
③m=1,+1价阳离子有:Ag+、Na+、K+等,只有氢氧化银是难溶于水的沉淀;Ag++OH-=AgOH↓;氢氧化银溶于氨水,硝酸银溶液滴入氨水,生成银氨溶液无明显现象;将氨水滴入硝酸银溶液中 产生沉淀,继续滴加沉淀溶解,互滴顺序不同现象不同,故③正确;
④m=2,硫酸亚铁中+2价铁在空气中易被氧化为+3价,其化学方程式为:FeSO4+2H2O⇌Fe(OH)2+3H2O;4Fe(OH)2+O2+2H2O=4Fe(OH), Fe2O3+3H2SO4=Fe(SO4)3+3H2O 总反应为:即硫酸亚铁溶液经蒸干、灼烧得到硫酸铁和氢氧化铁混合物,故④错误;
⑤m=3,常见金属中只有铁、铝符合条件,铝和过量氢氧化钠沉淀会溶解,故⑤错误;故选D.
考查方向
解题思路
不同考查了常见物质的性质应用,物质发生反应的特征应用,分析化合价的变化和特征是解题关键.
易错点
1、常见物质的性质应用
2、物质发生反应的特征应用
知识点
10.五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是
正确答案
解析
A. 非金属性,N> P>C ,不正确。
B. 半径越小,氢化物越稳定,R > M。
C. 做光导纤维的是二氧化硅。
D. 半径越小,非金属性越强,最高价氧化物对应的水化物酸性越强,故D正确。
考查方向
解题思路
先根据题干推出各元素,在灵活运用元素周期律。最先推出R元素,为S,然后根据,在周期表的位置,分别推出X:C Y:N Z:Al M:P。
易错点
1、元素周期律的表达方式。
2、短周期中各元素在周期表中的位置。
知识点
6.原子序数依次递增的4种短周期元素可形成简单离子,W2-、X+、Y3+、Z2-下列说法不正确的是( )
正确答案
解析
原子序数依次递增的4种短周期元素可形成简单离子:W2﹣、X+、Y3+、Z2﹣,则W、Z为第VIA族元素,原子序数W小于Z,则W为O元素,Z为S元素,X化合价为+1价,为第IA族的Na元素,Y为第ⅢA族,原子序数大于Na,则Y为Al元素。
A.工业上电解熔融氧化铝冶炼铝,正确;
B.非金属性W(氧)>Y(硫),非金属性越强,氢化物越稳定性,正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:S2﹣>O2->Na+>Al3+,错误;
D.W、X 形成的化合物为Na2O、Na2O2,两化合物中阴、阳离子个数比都是1:2,正确。
故选C。
考查方向
解题思路
原子序数依次递增的4种短周期元素可形成简单离子:W2﹣、X+、Y3+、Z2﹣,则W、Z为第VIA族元素,原子序数W小于Z,则W为O元素,Z为S元素,X化合价为+1价,为第IA族的Na元素,Y为第ⅢA族,原子序数大于Na,则Y为Al元素。
A.工业上电解熔融氧化铝冶炼铝;
B.非金属性越强,氢化物越稳定性;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.W、X 形成的化合物为Na2O、Na2O2。
易错点
本题考查结构性质位置关系应用,关键是根据短周期元素及离子电荷确定元素,注意对基础知识的理解掌握。
知识点
12.W、X、Y、Z是原子序数依次增大的短周期主族元素。W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍。下列说法错误的是
正确答案
解析
元素推断:W、X、Y、Z是原子序数依次增大的短周期主族元素,且W的气态氢化物的水溶液显碱性,说明W是N元素;Y元素的最高正化合价是其最低负化合价绝对值的3倍,说明Y位于第ⅥA,Y的原子序数大于X的,所以Y是S。X和Y同主族,原子序数依次增大,说明X是O元素,Z是Cl元素。阴离子的还原性:S离子>O离子 ,Cl离子属于强离子不会破坏水的电离平衡。答案选B。
考查方向
解题思路
本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
易错点
1、阴离子的还原性比较。
2、各元素性质和相应原子结构的周期性递变规律。
知识点
5.a、b、c、d四种元素在周期表中的位置如下图,则下列说法正确的是()
正确答案
解析
A.若b的最高价氧化物对应水化物为H2bO4,b为+6价,a显负价时为-3价,则a的氢化物的化学式为aH3,A正确;
B.若b的单质可作半导体材料,若b为硅,则c的单质为锗,可能为半导体材料,B错误;
C.非金属性越强,与氢气越易结合,若b的单质与H2易化合,则c的单质与H2不易化合,C错误;
D.a与b之间电负性较接近,不容易形成离子化合物,D错误。
故选A。
考查方向
解题思路
A.若b的最高价氧化物对应水化物为H2bO4,b为+6价,a显负价时为-3价,则a的氢化物的化学式为aH3;
B.若b的单质可作半导体材料,若b为硅,则c的单质为锗,可能为半导体材料;
C.非金属性越强,与氢气越易结合,若b的单质与H2易化合,则c的单质与H2不易化合;
D.a与b之间电负性较接近,不容易形成离子化合物。
易错点
本题考查学生元素周期律的应用知识,难度不大,注意掌握元素的最高正价+|最低负价|=8,根据化学式计算元素化合价。
知识点
8.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图示。已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
正确答案
解析
A.O分别与Mg、Si形成的化合物中化学键类型不相同,故A错误;
B.Si的最高价氧化物的水化物酸性比P的弱,故B错误;
C.O的简单气态氢化物的稳定性比P的强,故C错误;
D.原子半径的大小顺序:r(Mg)>r(Si)>r(P)>r(O),故D正确,
考查方向
解题思路
短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的最低负价与Y的最高正价代数和为零,则X为氧元素Y为Mg元素;Z、W是Si元素和P元素,据此解答.
知识点
X、Y、Z、W均为短周期元素,它们在周期表中的位置如右下图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析