- 元素周期律
- 共415题
以下元素均为短周期元素:
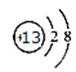
19.B在周期表中的位置 ,C离子的结构示意图 。
20.D的最低价含氧酸的电子式 。
21.M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式 。
22.A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:________________;
23.仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为 。
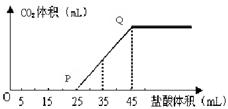
24.A的最高价氧化物的水化物的溶液中通入一定量CO2 得溶液X,X中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生
①X溶液中溶质的化学式________________。
②当加入35mL盐酸时,产生CO2的体积为_______________mL(标准状况)。
正确答案
第二周期第VIA族
解析
M属于非金属元素,其气态氢化物的水溶液呈碱性,可知M元素是N元素。短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.B在周期表中的位置第二周期第VIA族,C离子的结构示意图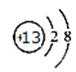
考查方向
解题思路
本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键。氧化还原反应以及离子反应这部分的核心是氧化还原反应以及离子反应原理就是,负极失电子发生氧化反应,正极得电子发生还原反应.所以负极的反应物的化合价要升高.正极得反应物的化合价要降低.写反应产物也是关键之一.要知道物质被氧化或还原到什么价态才能写方程式(根据化合价升降法)比如电池中锌只是单纯的失电子,而在铅蓄电池中铅还会和电解质中硫酸根离子反应?其实就是离子共存的问题,你的反应产物如果不能与电解质溶液中的离子共存自然就要发生反应。
正确答案
解析
M属于非金属元素,其气态氢化物的水溶液呈碱性,可知M元素是N元素。短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素。D的最低价含氧酸的电子式
考查方向
解题思路
本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键。氧化还原反应以及离子反应这部分的核心是氧化还原反应以及离子反应原理就是,负极失电子发生氧化反应,正极得电子发生还原反应.所以负极的反应物的化合价要升高.正极得反应物的化合价要降低.写反应产物也是关键之一.要知道物质被氧化或还原到什么价态才能写方程式(根据化合价升降法)比如电池中锌只是单纯的失电子,而在铅蓄电池中铅还会和电解质中硫酸根离子反应?其实就是离子共存的问题,你的反应产物如果不能与电解质溶液中的离子共存自然就要发生反应。
正确答案
2NH3 - 6e- + 6OH- === N2+6H2O
解析
M属于非金属元素,其气态氢化物的水溶液呈碱性,可知M元素是N元素。短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素。M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液)
负极:4NH3 -12e- +12OH- =2N2+12H2O
正极:3O2+12e- +6H2O=12OH-
总式:4NH3+3O2=2N2+6H2O
考查方向
解题思路
本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键。氧化还原反应以及离子反应这部分的核心是氧化还原反应以及离子反应原理就是,负极失电子发生氧化反应,正极得电子发生还原反应.所以负极的反应物的化合价要升高.正极得反应物的化合价要降低.写反应产物也是关键之一.要知道物质被氧化或还原到什么价态才能写方程式(根据化合价升降法)比如电池中锌只是单纯的失电子,而在铅蓄电池中铅还会和电解质中硫酸根离子反应?其实就是离子共存的问题,你的反应产物如果不能与电解质溶液中的离子共存自然就要发生反应。
正确答案
4Na+CCl4
解析
M属于非金属元素,其气态氢化物的水溶液呈碱性,可知M元素是N元素。短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.钠在真空高压下能与由碳、氯组成的分子呈正四面体结构的化合物CCl4反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:4Na+CCl4
考查方向
解题思路
本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键。氧化还原反应以及离子反应这部分的核心是氧化还原反应以及离子反应原理就是,负极失电子发生氧化反应,正极得电子发生还原反应.所以负极的反应物的化合价要升高.正极得反应物的化合价要降低.写反应产物也是关键之一.要知道物质被氧化或还原到什么价态才能写方程式(根据化合价升降法)比如电池中锌只是单纯的失电子,而在铅蓄电池中铅还会和电解质中硫酸根离子反应?其实就是离子共存的问题,你的反应产物如果不能与电解质溶液中的离子共存自然就要发生反应。
正确答案
CO32-+Cl2+H2O = ClO—+Cl-+HCO-3
解析
M属于非金属元素,其气态氢化物的水溶液呈碱性,可知M元素是N元素。短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O = ClO—+Cl-+HCO-3 。
考查方向
解题思路
本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键。氧化还原反应以及离子反应这部分的核心是氧化还原反应以及离子反应原理就是,负极失电子发生氧化反应,正极得电子发生还原反应.所以负极的反应物的化合价要升高.正极得反应物的化合价要降低.写反应产物也是关键之一.要知道物质被氧化或还原到什么价态才能写方程式(根据化合价升降法)比如电池中锌只是单纯的失电子,而在铅蓄电池中铅还会和电解质中硫酸根离子反应?其实就是离子共存的问题,你的反应产物如果不能与电解质溶液中的离子共存自然就要发生反应。
正确答案
NaOH Na2CO3 224
解析
M属于非金属元素,其气态氢化物的水溶液呈碱性,可知M元素是N元素。短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素.A的最高价氧化物的水化物的溶液中通入一定量CO2 得溶液X,X中逐滴加入1mol·L-1的盐酸,①X溶液中溶质的化学式NaOH Na2CO3 。②当加入35mL盐酸时,产生CO2的体积为224mL。
考查方向
解题思路
本题考查结构性质位置关系、常用化学用语、微粒半径比较等,难度中等,掌握元素化合物性质、原子结构推断元素是解题的关键。氧化还原反应以及离子反应这部分的核心是氧化还原反应以及离子反应原理就是,负极失电子发生氧化反应,正极得电子发生还原反应.所以负极的反应物的化合价要升高.正极得反应物的化合价要降低.写反应产物也是关键之一.要知道物质被氧化或还原到什么价态才能写方程式(根据化合价升降法)比如电池中锌只是单纯的失电子,而在铅蓄电池中铅还会和电解质中硫酸根离子反应?其实就是离子共存的问题,你的反应产物如果不能与电解质溶液中的离子共存自然就要发生反应。
13.X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲。X、Y、Z 3种元素形成化合物乙。下列说法错误的是
正确答案
解析
D.非金属性F最强,故氢化物中HF最稳定,常温下水为液态,而HF为气体,故熔点沸点H2O>HF,故D正确
C.Si元素的某种单质可在电子工业用于生产半导体材料。
B.化合物乙中一定只有共价键,NH4NO3还含有离子键。
A. 气体SO3可与H2O反应生成强酸
考查方向
解题思路
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,而Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味),则Z为O元素,可推知Y为N元素、M为F元素、W为Si,故甲为SO3,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等,
易错点
本题考查结构与位置关系、化学键等,难度中等,推断元素是关键,注意比较规律与基础知识掌握。
知识点
7.短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y 的次外层电子数是最外层的
正确答案
解析
A、Y、Z、W具有相同电子层结构的离子(O2-、Na+、Al3+),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,其半径依次减小,故A错误;
B、X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2),故B错误;
C、化合物X2Y、ZY、WY3 中化学键的类型相同,故C错误;
D、由X、Y、Z、W组成的化合物的水溶液可能显酸性故选C。
考查方向
解题思路
从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Al元素,R是S元素。
易错点
由原子结构判断元素;
知识点
11.X、Y、Z、R、W是5种短周期主族元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期,下列说法错误的是( )
正确答案
解析
X、Y、Z、R、W是5种短周期元素,原子序数依次增大.已知Y、R同主族,且形成共价化合物RY3,则R为S元素,Y为O元素;离子化合物Z2Y中Z的化合价为+1价,Y的化合价为-2价,分别为ⅠA族和ⅥA族元素,Z、R、W同周期,则Z为Na元素;W原子序数最大,则W是Cl元素,根据XW4可知X为C元素,A.同周期元素从左到右原子半径逐渐减小,Z、R、W同周期,分别为Na、S、Cl,原子序数逐渐增大,则原子半径逐渐减小;B.非金属性Cl>S,则氢化物稳定性HCl>H2S;C.X2W6分子为C2Cl6,每个C原子形成4个共价键,C原子最外层满足8电子稳定结构,Cl形成1个共价键,最外层电子数也为8;D.Y、Z、R三种元素组成的化合物有Na2SO3、Na2SO4等,其溶液分别呈碱性和中性;
考查方向
解题思路
X、Y、Z、R、W是5种短周期元素,原子序数依次增大.已知Y、R同主族,且形成共价化合物RY3,则R为S元素,Y为O元素;离子化合物Z2Y中Z的化合价为+1价,Y的化合价为-2价,分别为ⅠA族和ⅥA族元素,Z、R、W同周期,则Z为Na元素;W原子序数最大,则W是Cl元素,根据XW4可知X为C元素.
易错点
本题考查位置结构性质的相互关系应用,易错点是根据化学式判断元素的化合价推断元素可能存在的族。
知识点
11. X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01 mol/LX和W形成化合物的水溶液pH为2。下列说法不正确的是( )
正确答案
解析
A.非金属性越强,氢化物的稳定性越强,氧元素的非金属性大于S,则水的稳定性强于H2S的稳定性,故A最强;
B.Y为O、Z为Na,可以形成Na2O、Na2O2,Na2O2中的阴离子为O22-,Na2O中的阴离子为O2-,阴阳离子的个数比都为1:2,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;电子层越多半径越大,X为H、Y为O、Z为Na、R为S、W为Cl,Na、S、Cl同属于第三周期元素,同周期自左而右原子半径减小,所以Na>S>Cl;H属于第一周期元素,半径最小,O属于第二周期元素,半径大于H小于第三周期元素,故原子半径由大到小排列的是:Z>R>W>Y>X,故C正确;
D.Y为O、Z为Na,W为Cl,形成NaClO4属于强酸强碱盐,溶液呈中性,故D错误。
故选D。
考查方向
解题思路
X、Y、Z、R、W是原子序数依次增大的五种短周期元素,Y和R同主族,Y处于第二周期,R处于第三周期,可组成共价化合物RY2和RY3,则Y为氧元素,R为硫元素,RY2为SO2、SO3,W的原子序数大于硫元素,故W为Cl元素,Y和Z最外层电子数之和与W的最外层电子数相同,则Z的最外层电子数为7-6=1,处于第ⅠA族,原子序数大于氧元素,故Z为Na元素,25℃时0.01mol•L-1X和W形成化合物的水溶液pH为2,则X为氢元素。
易错点
本题考查位置结构性质的相互关系应用,难度中等,关键是根据化学式判断元素的化合价推断元素可能存在的族。
知识点
4.短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为17,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素。下列说法正确的是( )
正确答案
解析
A.原子的电子层数不同时,层数越大,半径越大,当电子层数相同时,原子序数越大,原子半径越小,所以X、Y、Z、W、M四种元素中M元素即铝元素半径最大,A错误;
B.H、N、O三种元素可以形成含有离子键和共价键的硝酸铵,所以B错误;
C.N的非金属性小于O,而非金属性越强,氢化物的稳定性越强,所以O的气态氢化物比N的气态氢化物更稳定,C错误;
D.Y4X8W2即为C4H8O2,其中为羧酸的有2种,为酯的有4种,同时含有羟基和醛基的有4种,含有两个羟基和一个碳碳双键的有8种等,所以C4H8O2物质超过10种,D正确。
考查方向
解题思路
根据“短周期元素X、Y、Z、W、M的原子序数依次增大,且X与Y是组成化合物种类最多的元素”可以确定X与Y分别为氢元素和碳元素;根据“W是地壳中含量最高的元素”可知W是氧元素,Z为氮元素,再根据“原子最外层电子数之和为17”可知M为铝元素;所以X、Y、Z、W、M五种元素分别为:氢元素、碳元素、氮元素、氧元素、铝元素; A.原子的电子层数不同时,层数越大,半径越大,当电子层数相同时,原子序数越大,原子半径越小, B.H、N、O三种元素可以形成含有离子键和共价键的硝酸铵;
C.非金属性越强,氢化物的稳定性越强; D.Y4X8W2即为C4H8O2,其中为羧酸的有2种,为酯的有4种,同时含有羟基和醛基的有4种,含有两个羟基和一个碳碳双键的有8种等,
易错点
不能准确提取有关元素结构和性质的信息,不能准确把握元素周期律以及有关元素化合物的性质。
知识点
11.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质。已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol·L-1己溶液的pH为12。下列说法不正确的是( )
正确答案
解析
A.1.0L 0.1mol·L-1戊溶液中阴离子为CO32_,CO32_离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,A说法正确;
B.Na2O2具有强氧化性,加入到酚酞试液中,溶液先变红后褪色,所以B说法正确;
C.NaH、碳酸钠、氢氧化钠均为离子化合物,所以C说法正确;
D.离子的电子层数数相同时,原子序数越大,离子半径越小,所以钠离子半径小于于氧离子半径,D错误;
考查方向
解题思路
根据0.01 mol•L-1己溶液的pH为12(25℃),己是一元强碱且其中的金属元素在短周期,甲+丙=丁+己,甲+乙=戊+丁;则“丁”是氧气,“己”是氢氧化钠,那么甲是Na2O2、乙是二氧化碳,丙是水,戊是碳酸钠,因此X为氢、Y为碳、Z为氧、W为钠元素;
A.1.0L 0.1mol·L-1戊溶液中阴离子为CO32_,由于碳酸根的水解,所以总的物质的量大于0.1mol
B.Na2O2具有强氧化性,加入到酚酞试液中,溶液先变红后褪色
C.NaH、碳酸钠、氢氧化钠均为离子化合物;
D.钠离子半径小于于氧离子半径;
易错点
不能准确提取有关元素结构和性质的信息,不能准确把握元素周期律以及有关元素化合物的性质。
知识点
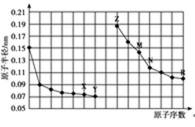
11.下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
正确答案
解析
A.金属性越强,最高价氧化物对应水化物的碱性越强:Z>M,A错误;
B.Y、R两种元素气态氢化物分别是HF、HCl,氟化氢分子之间形成氢键,Y、R两种元素气态氢化物的沸点:Y>R,B错误;
C.X为O元素、Z为Na元素、M为Al元素,三种元素的简单离子核外电子排布相同,核电荷数越大,离子半径越小,因此简单离子的半径:M<Z<X,C正确;
D.X、N两种元素组成的化合物是二氧化硅,二氧化硅与氢氟酸反应,D错误。
故选C。
考查方向
解题思路
由图可知:X为O元素;Y为F元素;Z为Na元素;M为Al元素;N为Si元素;R为Cl元素,据此作答:
易错点
本题解题的关键是推断出各元素的名称,据此作答,本题较为简单。
知识点
10.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是 ( )
正确答案
解析
A.阳离子原子序数=核外电子数+电荷数,阴离子原子序数=核外电子数-电荷数,所以若X+和Y2-的核外电子层结构相同,则原子序数:X>Y,故A正确;
B.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,故B错误;
C.在金属和非金属性元素的交界处的单质能作半导体材料,硅、锗都位于金属与非金属的交界处,都可以做半导体材料,故C正确;
D.同周期元素从左到右,元素的金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故D正确。
故选B。
考查方向
解题思路
A.X+和Y2-的核外电子层结构相同,阳离子原子序数较大;
B.元素的非金属与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关.
C.在金属和非金属性元素的交界处的单质能作半导体材料;
D.同周期元素自左而右金属性减弱,金属性Cs>Ba,金属性越强最高价氧化物对应水化物的碱性越强,故碱性CsOH>Ba(OH)2;
易错点
本题涉及元素周期律中非金属性和金属性强弱的判断、原子序数的判断等知识点,根据元素在周期表中的位置结合元素周期律来解答,熟记元素周期律内容,题目难度不大。
知识点
11. W、X、Y、Z是四种原子序数依次增大的短周期主族元素。W元素的最高正化合价与最低负化合价的代数和为0,X元素原子的电子层数是最外层电子数的3倍,Y元素原子M层上的电子数为6。则下列说法正确的是
正确答案
解析
A.原子半径:S > Cl > O,错误;
B.简单阴离子还原性:S2- > Cl-,错误;
C.最高价氧化物对应水化物的酸性:HClO4 > H2SO4,正确;
D.C与Cl形成的化合物可能是CCl4,CCl3,CCl2,CCl,不一定是易溶于水的气体,错误;故答案为C。
考查方向
本题主要考查了原子结构与元素周期律的关系;硫及其化合物氯及其化合物;碳、硅及其化合物元素周期律。
解题思路
本题考查了原子结构和元素周期律知识,熟悉元素周期表结构及原子结构是解本题关键,再结合元素周期律分析解答,正确推断元素即可解答,题目难度中等。W元素的最高正化合价与最低负化合价的代数和为0,则W为C或者Si,X元素原子的电子层数是最外层电子数的3倍,则X为O或S,Y元素原子M层上的电子数为6,则Y为S,又因为W、X、Y、Z是四种原子序数依次增大的短周期主族元素,则W为C,X为O,Y为S,Z为Cl;
易错点
1、原子结构与元素周期律的关系。
2、短周期元素原子电子层数与阳离子特点,推导简单阴离子还原性。
知识点
扫码查看完整答案与解析