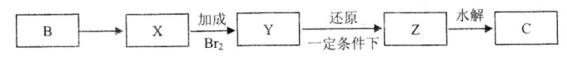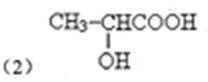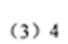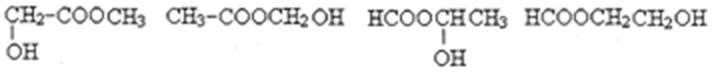- 化学科学特点
- 共348题
民以食为天,下列处理食品的方法,不会危及人体健康的是
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
布朗运动是指液体中悬浮固体小颗粒的运动,不是液体分子的运动,故A正确B错误;物体从外界吸收热量,有可能同时对外做功,其内能不一定增加,同理,物体对外做功,有可能同时从外界吸收热量,其内能不一定减少,故CD错误。本题选A。
知识点
34.请从给出的3道化学题中任选一题作答,如果多做,则按所做的第一题计分。
1.【化学—选修2:化学与技术】
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)为除去天然水中含有的一些悬浮物和胶体,可加入的混凝剂是 ______(任写一种物质的名称),请用离子方程式解释其净水作用的原理:______ 。
(2)离子交换法是用离子交换剂软化水的方法。将RH型阳离子交换树脂和ROH型阴离子交换树脂串接以软化天然硬水,应先使硬水通过_______ (填“RH”或“ROH”)型离子交换树脂,原因是________________________。
(3)污水处理的技术很多,可分为物理法、生物法、化学法等。ClO2不仅是一种性能优良的饮用水消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的离子除去。写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式:________________ 。
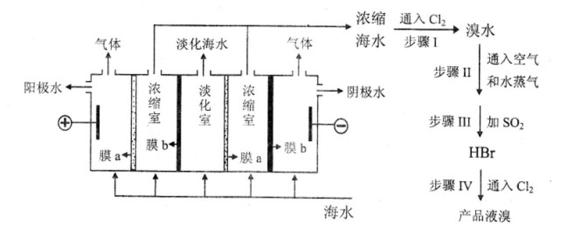
(4)随着淡水资源的日益匮乏,人们将目光转向了海水。如图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
①图中膜a应选择 __________(填“阳离子交换膜”或“阴离子交换膜”)。
②图中步骤I中已获得Br2,步骤Ⅲ中又将Br2还原为Br-,其目的是________,若海水中溴含量为0.07mg·cm-3,则年产21000 t液溴需要处理海水的体积为___________m3.
2.【化学—选修3:物质结构与性质]】
A、B、C、D、E、F六种元素的原子序数依次增大。F元素的原子序数为29,其余元素均为主族元素。A是元素周期表中电负性最大的元素,B原子半径是同周期中最大的(除稀有气体外),C原子的次外层电子数是最外层电子数的4倍,D、E原子的p轨道中均只有l个未成对电子。
(1)基态F原子的价电子排布式是_________ 。
(2)B、C、D三种元素第一电离能从大到小的顺序是 __________(填元素符号)。
(3)写出与A的气态氢化物互为等电子体的一种微粒的化学式:_____________ 。
(4)含D元素的一种重要化合物LiDH4,可将有机物中的羧基还原为羟基。
例如:CH3COOH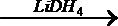
①在LiDH4中DH4-的立体构型为 ________________ 。
②在CH3COOH分子中碳原子轨道的杂化类型是___________,
(5)C的氧化物W的晶胞结构与BE相似。在W中C离子的配位数是______,若W的密度是________ag·cm-3,则W晶胞的边长为______cm(只要求列算式不必计算出数值,阿伏加德罗常数为NA)。
3.【化学—选修5:有机化学基础】
有机化合物A、B、C、D完全燃烧均只生成CO2和H2O,且四种分子中碳的质量分数均为

①A常温、常压下呈气态,A、C都能发生银镜反应,但都不能发生水解反应;
②B和C互为同分异构体,l mol B完全燃烧需耗3mol氧气。核磁共振氢谱表明,B分子有四个吸收峰,且峰面积之比为3:1:1:1,B在浓硫酸存在下加热可生成W(C6H8O4,含六原子环);
③RCOOH在一定条件下可被还原为RCHO,以下是由B制取C的一种合成路线(反应条件及副产物已略去):
试回答:
(1)A含有的官能团名称为_______,它与苯酚在酸催化下,可生成一种高分子化合物,该高分二子化合物的结构简式为 _________ 。
(2)B的结构简式为________ 。反应B→X的化学方程式为 _________。
(3)与B互为同分异构体,属于有机酸的酯类且含有羟基的化合物有 _______ 种,写出其中一种的结构简式:___________。
(4)写出Z→C的化学反应方程式:__________ 。
(5)若MD=6MA,D是只含有一种官能团的六原子环状物,又名肌醇。医学上将肌醇用于动脉硬化、高血脂症、脂肪肝的防治。则D的结构简式为 ___________。
正确答案
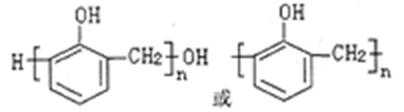
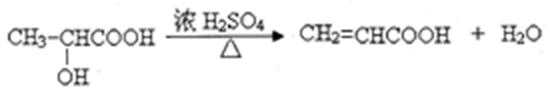
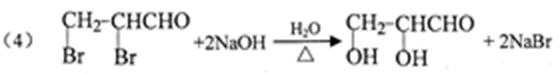
正确答案
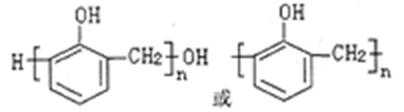
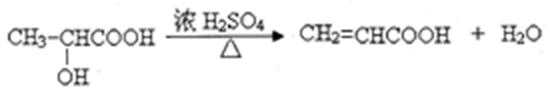
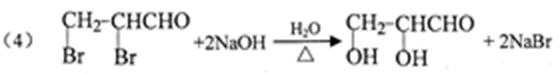
正确答案
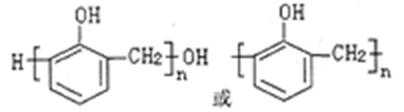
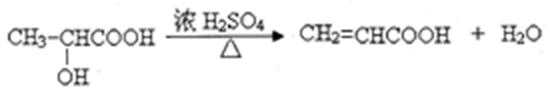
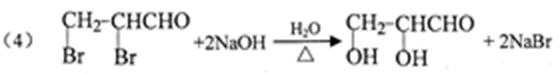
34.请从给出的3道化学题中任选一题作答,如果多做,则按所做的第一题计分。
1.【化学——选修2:化学与技术】
海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和金属镁的制备原料都来自于海水。
Ⅰ、在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。

(1)写出两电极的反应式:
阳极________________________________________________________________________,
阴极________________________________________________________________________。
(2)石棉隔膜的作用是_________________________________________________________。
Ⅱ、随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子膜电解技术取代。
(1)离子膜电解槽(如图乙所示)中⑥、⑦分别是______________、__________。
(2)已知一个电子的电量是1.602×10-19 C,在离子膜电解饱和食盐水时电路中通过电子1.929×105 C,则产生NaOH________g。
Ⅲ、下图是工业上生产镁的流程。
(1)写出下列反应的化学方程式:
①沉淀池中:__________________________________________________________。
②电解:______________________________________________________________。
(2)整个生产流程中,循环使用的物质是__________。
2.【化学——选修3:物质结构与性质】
已知短周期元素Y原子的最外层电子数比内层电子总数少3,它与元素X所形成化合物分子XY4含有104个电子。试回答:
(1)X元素的原子基态时电子排布式为 _____________;Y元素原子最外层电子的轨道表示式为 ______________________。
(2)化合物XY4的空间结构为 _____________________,
(3)同主族元素Z、 R形成的化合物ZR具有类似金刚石的结构和性质,则ZR中心原子的杂化类型为 _______________。1molZR中含有 _________molZ—R键。若ZR晶胞边长为a,则ZR的密度为________________(阿伏加德罗常数为NA)
(4)元素Y与元素Z所形成的化合物投入水中,产生大量白雾和一种白色胶状沉淀。写出化学方程式_______________________。
3.【化学——选修5:有机化学基础】
在芳香烃X的质谱图中,质荷比的最大值为92。X能使酸性KMnO4溶液褪色,生成的有机物能和NaHCO3反应放出气体。以X为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),其中A的相对分子质量为126.5,H是一种功能高分子,链节组成为C7H5NO。
已知: 
请根据所学知识与本题所给信息回答下列问题:
(1)A→B的反应类型____________,D的名称___________
(2)H的结构简式是____________,由F 转化为G所加试剂 ________________。
(3)阿司匹林片碱性水解的化学方程式_______________________
(4)同时符合下列四个要求的Y(水杨酸)的同分异构体共有2种,任写出其中一种的结构简式________________________
①含有苯环;②能发生银镜反应,不能发生水解反应;③遇FeCl3溶液显紫色;④核磁共振氢谱只出现4组峰,且峰面积之比为1:2:2:1
(5)设计4步由
例:由乙醇合成乙烯的反应流程图可表示为:
正确答案
38.
正确答案
38.
正确答案
34.请从给出的3道化学题中任选一题作答,如果多做,则按所做的第一题计分。
1.工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( TETiO3).其中一部分铁元素在风化过程中会转化为+3价。
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异
b.溶解性差异
c.氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离
子方程式为___________
(5)利用右图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
2.铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。
(1)铁、钴、镍都是很好的配位化合物形成体。
①




H2O分子的立体构型为__________。
②铁、镍易与一氧化碳作用形成羰基配合物,如:
于等电子体,则CO分子中

(2)+2价和+3价是Fe、Co、Ni等元素常见化合价。
NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和F22+的离子半径分别为69 pm和78 pm,则熔点NiO____FeO(选填“<”“>”“=”); 某种天然Nio晶体存在右图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈屯中性。某氧化镍样品组成为
3.烃A有如图的转化关系:
(1)物质C的分子式为____________.物质A的结构简式为_________________,
⑥的反应类型为__________,H中含氧官能团的名称为___________________.
(2)D的核磁共振氢谱图中会出现____________组吸收峰。
(3)写出E-F的化学反应方程式__________________。
(4)G的同分异构体中能同时满足如下条件:
①苯环上只有三个取代基,含有碳碳双键。
②能发生银镜反应,遇氯化铁溶液显紫色。
G共有____种同分异构体(不考虑立体异构),写出其中一种的结构简式____。
正确答案
正确答案
正确答案
18. (4分)取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应。甲加入50mLpH=2盐酸,乙加入50mL pH=2醋酸,丙加入50mL pH=2醋酸及少量的胆矾粉末。
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为( )以上用“甲、乙”和 “> 、 < 、 =” 回答)
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌。回答以下问题。
①三支试管中参加反应的锌的质量大小关系为:( )
(用“甲、乙、丙”和 “> 、 < 、 =” 回答)
②反应终了,所需时间为:( )(同①)
③若以上三组实验,锌粉均过量,产生的氢气体积 ( )(同①)
正确答案
(1)甲>乙 (2)①丙>甲=乙 ②甲>乙>丙 ③乙=丙>甲
解析
解析已在路上飞奔,马上就到!
知识点
34.请考生从给出的3道化学题任选一题作答,如果多做,则按所做的第一题计分。
1.【化学一选修2化学与技术】
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
(1)电解生成的铝在熔融液的 _____(填“上层”或“下层”),电解时不断消耗的电极是____ (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式_______ 。
(3)电解制备铝时,需加入冰晶石(Na3AIF6),其作用是 _______,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出 该反应的化学方程式________;
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是____(填化学式),阳极的电极反应式为__________。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见右图),此时铝表面可形成耐酸的致密氧化膜,其电极反应式为__________;
②钢材镀铝后,能防止钢材腐蚀,其原因是_______。
2.【化学一选修3物质结构与性质】
VA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为 _________(用元素符号表示)。
(2)As原予核外M层电子的排布式为____________。
(3)叠氮化钠(NaN3)用于二汽车安全气囊中氮气的发生剂,写出与N—3互为
等电子体的分子的化学式_________ (任写一种即可)。
(4)白磷(P4)的结构如右图所示,P原子的轨道杂化方式是_______ 。
(5)NO—2可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:
①NO—2的立体构型是 ________。
②在K3 [Co(NO2)6]中,中心离子的配位数为_____。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为 g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
3.【化学一选修5有机化学基础]】
丙酮酸乙酯(CH3COCOOCH2CH3)具有甜润的花果香气,可用于苹果、柑橘、巧克力等香精的调配,在医药、农药、化妆品等行业中也有广泛用途。以下是某课题组设计的从廉价、易得的化工原料出发制备丙酮酸乙酯的合成路线:
已知以下信息:
①醛(或酮)在NaOH溶液中与HCN反应,可引入腈基(-CN),使碳链增长。
如:
②腈在酸性条件下水解生成羧酸。
如:
回答下列问题:
(1)C2H4的某种二氯取代物CICH - CHCI是否存在顺反异构?_____(填“是”或“否”)。
(2)反应⑥投料时,通常使B原料过量,其目的是________;B的质谱图中,某碎片离子的质荷比为31,该碎片离子所含碳、氢、氧原子数之比为____。
(3)反应①~⑥中,属于加成反应的是______(填写反应编号),D的结构简式是____。
(4)写出反应⑤的化学方程式 _________。
(5)E在催化条件下可聚合成一种易降解的高分子化合物,写出该聚合反应的化学方程式________。
(6)B与E酯化或丙酮酸乙酯与氢气加成,均可生成有机物G(C5H10O3)。G的同分异构体中能发生银镜反应和水解反应,还能与金属钠反应生成氢气的共有____种(不考虑立体异构),其中核磁共振氢谱有四种不同化学环境氢原子的异构体是______(写出其中一种的结构简式)。
正确答案
正确答案
正确答案
34.请考生从给出的3道化学题中任选一道作答,如果多做,则按所做的一题计分。
1.【化学——选修2:化学与技术】
煤是重要的能源,也是生产化工产品的重要原料。试用所学
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为_____ 和________
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为__________,
第二步反应的离子方程式为_______________________ 。
(3)工业煤干馏得到的产品有焦炭、_______ 、____________等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:__________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_______________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
2.【化学──选修物质结构与性质】
已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
(1)A原子的最外层电子排布式______,D原子共有 ________种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系:_____> _____(填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 _______;分子较稳定的是________。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 ______。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。
3.【化学—选修:有机化学基础】
芳香化合物A(
请回答下列问题:
(1)请写出A的分子式______________________
(2)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠_______ mol
(3)有机物C可以由乳酸(
a.消去、加成、水解、酸化
b.氧化、加成、水解、酸化
c.取代、水解、氧化、酸化
d.消去、加成、水解、氧化
(4)写出由E制得F的化学方程式:__________,反应类型是_____________
(5)有机物B与乙酸酐(CH3COOCOCH3)直接反应制得阿司匹林(即乙酰水杨酸,分子式C9H8O4),满足以下条件的阿司匹林的同分异构体有_______种,写出其中任意两种的结构简式:__________ 、_____________
①苯环上只含有两个侧链 ②有两个酯基 ③能发生银镜反应
正确答案
(1)C10H7O4Cl (2)4 (3)a
(4)
(5)9种 

正确答案
(1)C10H7O4Cl (2)4 (3)a
(4)
(5)9种 

正确答案
(1)C10H7O4Cl (2)4 (3)a
(4)
(5)9种 

34.请考生从给出的3道化学题中任选一题做答,如果多做,则按所做的第一题计分。
1.【化学——选修2:化学与技术】
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
(1)搅拌加热操作过程中发生反应的离子方程式为:__________________;______________。
(2)生产过程中B和D的操作名称分别是 ________ 和 ___________(B和D均为简单操作)。
(3)反应中副产品a是______________。
(4)生产过程中可循环使用的物质是 ________________(用化学式表示)。
(5)调节pH至4.0~4.5的目的是 _________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用下列物质中的 ______________ 。
A.氢氧化钠
B.铝
C.氨水
D.氧化铝
E.偏铝酸钠
2. 【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)G位于____ 族______ 区,价电子排布式为_________________
(2)B基态原子中能量最高的电子,其电子云在空间有 __________个方向,原子轨道呈___________形.
(3)画出C原子的电子排布图__________________.
(4).已知BA5 为离子化合物,写出其电子式 ______________.
(5)DE3 中心原子的杂化方式为 ___________,用价层电子对互斥理论推测其空间构型为____________ .
(6)用电子式表示F元素与E元素形成化合物的形成过程_______________
3.【化学—选修5:有机化学基础】
根据下图填空。
(1)化合物A含有的官能团是___________ 。
(2)1 mol A与2 mol H2反应生成1 mol E,其反应方程式是____________________________________。
(3)与A具有相同官能团的A的同分异构体的结构简式是__________。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是__________。
(5)F的结构简式是__________。由E生成F的反应类型是__________。
(6)写出A―→B的化学方程式______________________________________________。
正确答案
正确答案
(1)碳碳双键、醛基、羧基
正确答案
(1)碳碳双键、醛基、羧基
34.请考生从给出的3道化学题中任选1题解答,如果多做,则按所做的第一题计分。
1.【化学—选修化学与技术】
海水是一种丰富的自然资源,工业上可以从海水中提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
回答下列问题:
(1)流程图中操作a是________ 操作。
A.分馏
B.渗析
C.萃取、分液
D.蒸发结晶、过滤
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入足量气体A,后通入足量气体B,充分反应后过滤得到晶体C和滤液D。将晶体C灼烧即可制得纯碱。
①则气体A应是_______(填化学式),该反应过程的化学方程式为______ 。
②工业上向滤液D中通入NH3,并加入细小的食盐颗粒,冷却后能析出不含NaHCO3的副 产品NH4Cl晶体,请说明析出NH4Cl晶体的原因及通入NH3的作用___________ 。
③请列举出从海水中得到的精制食盐的其它工业用途:______________ 。
(3)镁是一种用途广泛的金属材料,目前世界上60%的镁从海水中提取,流程图中操作b是在氯化氢气氛中进行。若在空气中加热,则会水解生成Mg(OH)Cl。请写出在空气中加热生成Mg(OH)Cl的化学方程式 __________。
(4)某氯碱厂每天消耗的234吨NaCl,能够生产出质量分数为32%的烧碱溶液500吨,请计算同时转移的电子的物质的量是_____________ 。
2.【化学—选修物质结构与性质】
已知A、B、C、D、E、F、G、H八种元素位于元素周期表前四周期,其中只有D、E是金属元素且D是地壳中含量最多的金属元素,E的单质是日常生活中用途最广泛的金属。A、B的原子核外电子数和与C原子的核外电子数相等且A、B、C能形成离子化合物。G是B是同周期相邻元素且G原子基态时未成对电子数与其周期序数相等,B与H位于同一主族,D、H、F位于同一周期且原子序数依次增大,F原子的最外电子层上的p电子数是s电子数的两倍。请用化学用语回答以下问题:
(1)E的基态电子排布式为 _______。金属E形成的晶体,堆积模型是体心立方堆积方式,则配位数为:__________ 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为__________
(3)A、C、G可形成一种相对分子质量为72的一元羧酸分子,该分子中存在的

(4)由C、F形成的酸根离子FC的VSEPR模型名称是:________,该离子中,F原子的杂化轨道类型:__________;由A、C、F与钠四种元素按原子个数比为1:3:1:1组成的一种化合物,其水溶液呈酸性的原因是________,向该溶液中滴入酸性高锰酸钾溶液时发生反应的离子方程式为 ___________ 。
3.【化学—选修有机化学基础】
盐酸莱克多巴胺(一种兴奋剂,也是瘦肉精中的一种)临床上用于治疗充血性心力衰竭症,肌肉萎缩症,能增长肌肉,减少脂肪蓄积。在一些国家被批准用于动物营养重新分配剂,广泛地用于畜牧业和养殖业。虽然引起瘦肉精中毒事件的是盐酸克伦特罗,但我国相关部门严令禁止动物饲料使用任何种类的瘦肉精。盐酸莱克多巴胺的一种合成路线如下:
试回答下列问题:
(1)写出覆盆子酮分子中所含官能团的名称 ________,A→B的反应类型是 _____;
(2)B的纯品为白色固体,由A生成B的反应需45℃水浴较长时间加热,制得的B往往带有粉红色,原因是________,在反应过程中需持续通入氮气,其作用是 _______;
(3)写出B的结构简式 _____________;
(4)C、D均为A的同分异构体,都能发生银镜反应和水解反应,且水解液酸化后加入氯化铁溶液均能发生显色反应。C和D的核磁共振氢谱分别有6个和4个吸收峰。写出C所有可能的结构简式__________,写出D与足量氢氧化钠溶液共热的化学方程式 _____________ 。
正确答案
正确答案






正确答案






扫码查看完整答案与解析