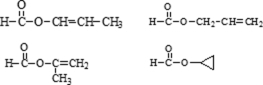
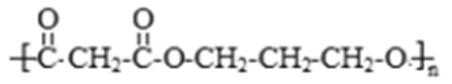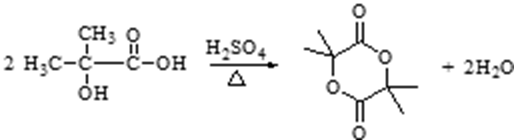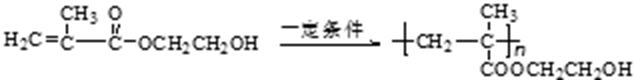- 有机物的结构式
- 共108题
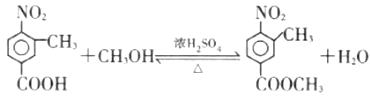
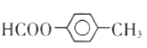
化学事故:2015年1月30日湖北107国道湖北孝感段发生危险化学品泄漏,上百人中毒,1人死亡。经公安部门侦查及卫生部门医学诊断,判断为高毒类有机物硫酸二甲酯泄漏引发的人员中毒。该物质在有机合成中用作甲基化试剂(提供-OCH3)。但随着对此研究的深入,该有毒物质的应用范围越来越小,相信不久将被无毒的有机物M完全取代。
现有一种有机香料A是经过有机物M作为甲基化试剂合成的(注意:取代基不能全部相邻)。
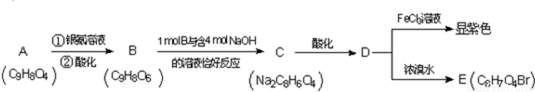
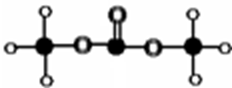
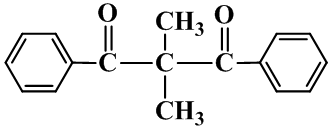
61. 有机物M结构的球棍模型如图所示。
有机物M的分子式为: ,名称为 。
写出M在氢氧化钠溶液中反应的化学方程式: 。
62. 写出A分子中官能团的名称: ;(除甲氧基外)
根据上述信息 (选填“能”或“不能”)确定A的结构式,原因是 。
63. A可以发生的反应是 ;
a.还原反应
b.氧化反应
c.酯化反应
d.水解反应
64. 符合下列要求的A的同分异构体共有 种。
① 含有苯环; ② 能发生银镜反应; ③ 1mol该异构体能与2molNa反应;
④ 苯环上只能生成三种一氯代物。
65. 写出下列反应的反应类型和化学方程式:
① A→B: ;
② D→E: 。
有机推断1:烃的衍生物的转化关系是复杂的。对这些转换进行推断考验学生的创新思维、严密思维、发散思维、耐力、恒心和意志品质,确实是难能可贵。
66. 检验A中卤元素的实验方法是 。
67. B的结构简式为 ;①的化学反应类型是 。
68. G在实验室中可通过两步反应氧化成F。其中第一步反应的条件是 ,
反应得到的产物可能有 (填写结构简式)。
69. F是一种二元酸,它在一定条件下可与G反应生成高分子化合物,该高分子的结构简式为 。写出反应④的化学反应方程式: 。
有机推断2:推断无止境,边界由我定!题海后浪推前浪,一浪更比一浪强!
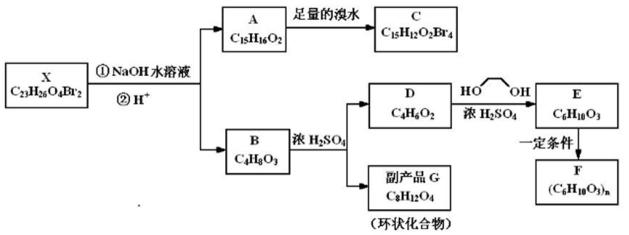
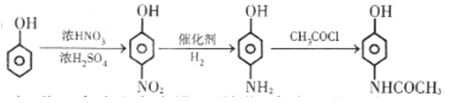
已知化合物X是一种环境激素,可以发生如图所示的转化。其中,化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种;1H-NMR谱显示化合物G的所有氢原子化学环境相同;F是一种可用于制备隐形眼镜的高聚物。
70. 关于上图中的物质,下列说法正确的是 。
a. 化合物A中含联苯(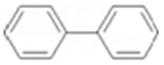
b. 化合物A可以和NaHCO3溶液反应,放出CO2
c. 理论上1mol X最多与6mol NaOH反应
d. 化合物D能与Br2发生加成反应
e. 理论上1mol X最多与8mol H2发生加成反应
f. 化合物G含有两个六元环
71. 写出化合物E的系统命名: ;写出C的结构简式: ;
写出A→C的反应类型是: ;X的结构是否唯一确定? (选填“是”或“否”)。
72. 写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)。
① 属于酯类;② 能发生银镜反应。 。
73. 写出下列反应的反应类型和化学方程式:
① B→G: ;
② E→F: 。
有机物存在纷繁复杂的同分异构体,书写同分异构体是考验化学学习者、研究者创新思维、严密思维、发散思维、耐力、恒心、意志品质的综合课题。
X(
74. 请写出满足下列条件的所有X的同分异构体。
① 含有两个苯环(除苯环外不含其它环状结构);
② 只存在四种化学环境不同的氢原子。
正确答案
见解析。
解析
61. C3H6O3 碳酸二甲酯;
62. 醛基、酯基;不能 两个取代基与酚羟基的位置有两种
63. abd
64. 10
65. ① 氧化反应
② 取代反应
66. 取少量A于试管,加入氢氧化钠溶液加热至不分层一段时间,冷却后加入稀硝酸至溶液呈酸性,滴加硝酸银溶液(或过量硝酸酸化的硝酸银溶液),如果有淡黄色沉淀出现,则A中含溴元素。
67. H2C=CH-COOH 消去反应
68. Cu(或Ag),加热;HO-CH2-CH2-CHO、OHC-CH2-CHO
69.
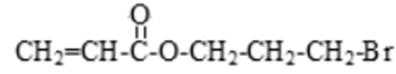
70. cd
71. (2-)甲基丙烯酸乙二(醇)酯;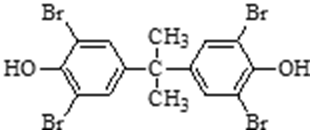
72.
73. ① 酯化反应/取代反应
② 加聚反应
74. 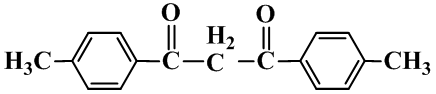
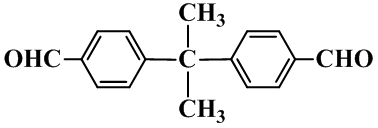
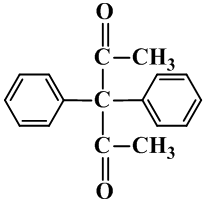
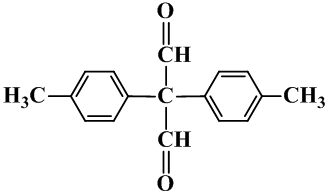
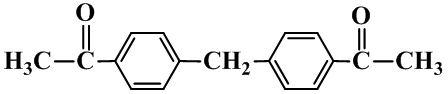
知识点
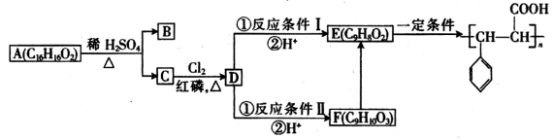
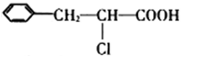
30.某有机物B是芳香烃的含氧衍生物,它的相对分子质量介于90和130之间,其中氧的质量分数为14.81%,向有机物B中滴入FeCl3溶液不显紫色。有机物A在一定条件下可发生下列反应:
已知:
(1)B的结构简式为_________,B中含氧官能团的名称是_________。
(2)D的结构简式为_________,反应条件Ⅰ是_________。
(3)反应
(4)C的同分异构体中,同时满足下列要求的同分异构体的结构简式为_________。
a.苯环上有两个侧链
b.苯环上只有两种一氯代物
c.能发生银镜反应
d.能发生消去反应
e.分子结构中不含甲基
(5)写出反应F→E的化学方程式:___________________________。
正确答案
(1)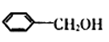
(2)
(3)取代反应
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
36.【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是___________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
37.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。
(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
38.有机物A~H均含苯环,它们之间的转化关系如下。已知:B与FeCl3溶液混合无颜色变化。
回答下列问题:
(1)B的结构简式为 。
(2)①~⑦中属于取代反应的是 (填序号)。
(3)写出一种可鉴别D、F的试剂: 。
(4)写出反应⑦的化学方程式: 。
(5)写出同时符合下列条件的C的同分异构体的结构简
式: 。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基中分别含有醇羟基、酚羟基和醛
36.【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是___________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式
37.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是 ,B、C、D的电负性由小到大的顺序为__ (用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是 。
(2)E原子的基态电子排布式为 。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为 。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
38.有机物A~H均含苯环,它们之间的转化关系如下。已知:B与FeCl3溶液混合无颜色变化。
回答下列问题:
(1)B的结构简式为 。
(2)①~⑦中属于取代反应的是 (填序号)。
(3)写出一种可鉴别D、F的试剂: 。
(4)写出反应⑦的化学方程式: 。
(5)写出同时符合下列条件的C的同分异构体的结构简
式: 。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基中分别含有醇羟基、酚羟基和醛
正确答案
正确答案
(1)
(2)①③⑦
(3)溴的四氯化碳溶液(或Na2CO3溶液等其他合理答案均可)
(4)
正确答案
(1)
(2)①③⑦
(3)溴的四氯化碳溶液(或Na2CO3溶液等其他合理答案均可)
(4)
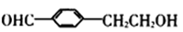
30.奶油中有一种只含C、H、O三种元素的化合物A,其相对分子质量为88,分子中C、H、0原子个数比为2:4:1。
已知:① ROH+HBr(氢溴酸)
②
A中含有碳氧双键,与A相关的反应如下图所示(图中无机产物已略去):
(1)A的分子式为 ( ) 。
(2)与A互为同分异构体的脂共有( )种:写出其中任意一种的结构简式:( ) (3)写出A→E、E→F的反应类型:A→E ( )、E→F ( )。
(4)写F的结构简式:F ( ) 。
(5)写出B→D反应的化学方程式; ( )
(6)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种。A→G的化学反应方程式为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30.有机物A~G有如右图的关系,已知C是高分子,两分子A能生成一分子 E, E是一个含有六元环的化合物,分子式为C6H8O4,A和G在浓硫酸和加热的条件下按2∶l的比例反应生成D,l mol D与足量金属Na起反应,放出1mol H2。
请回答下列问题:
(1)写出下列反应类型 :A→B__________、B→C__________、A→E__________;
(2)写出A、C和G的结构简式:C__________、D__________、G___________;
(3)写出下列反应的化学方程式:①A→E___________________________________; ②F→A____________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
36.请从36-38题中任选一题作答。
36.【化学—选修2:化学与技术】
生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在( )
A.西部山区 B.沿海地区 C.发达城市 D.东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式①( ),②( ),③ ( ),④( ),⑤ ( )。
(3)沸腾炉中发生反应的化学方程式 ( ),磷肥厂的产品是普钙,其主要成份是( )(填化学式)。
(4)热电厂的冷却水是( ),该流程中浓缩盐水除提取盐以外还可提取的物质有( )(写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想( ),( )(请写出两点)。
37.【化学—选修3物质结构与性质】
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第__________周期__________族,与N3-含有相同电子数的三原子分子的空间构型是__________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为( )。
(3)Cu+的电子排布式为___________,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O____________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角。(填“大于”、“等于”或“小于”)
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式__________。
(6)Cu3N的晶胞结构如右图,N3-的配位数为__________,Cu+半径为a pm,N3-半径为bpm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)(1pm=10-10cm)
38.【化学—选修5:有机化学基础】
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
(1)A、C的结构简式分别是( )、( ) 。D中含有的含氧官能团名称是 ( )。
(2)C→D的反应类型是 ( )。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 ( ) 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:( ) 。
①能发生银镜反应 ②一定条件下可发生水解反应 ③分子的核磁共振氢谱中有四组峰。
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
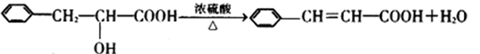
30.已知:
信息I: 有机物的转化存在以下计量上的关系:
信息II: 有机物A、B、C、D、E、F之间存在如下的转化关系:
其中:有机物D在浓硫酸作用下发生分子内脱水,可形成具有五元环状结构的有机物G。
根据上述信息,完成下列问题:
(1)有机物A的分子式为:( ) ;分子中含有的官能团名称为 ( );
(2)上述①~⑥转化关系中,属于取代反应的是( )(填序号);
(3)请写出G的结构简式:( );
(4) A的一种同分异构体H能与
(5)写出反应①的化学方程式( )。
正确答案
(1)
(2)
(3)
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
30.有机物F是合成新型降压药替米沙坦的中间体,可由下图所示的路线合成:
(1)B中含氧官能团的名称是__________。
(2)A→B的反应类型属于__________,E→F的反应类型属于__________。
(3)C→D的化学方程式为________________________________________。
(4)关于E的下列说法正确的是__________(填正确答案标号)。
A. 可以与氢氧化钠溶液发生反应 B. 苯环上的二氯代物有3种
C. 1mol E能与4mol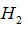
(5)满足下列条件的B的所有同分异构体有__________种。
①含苯环②含酯基 ③能与新制氢氧化铜悬浊液反应生成红色沉淀写出其中苯环上一氯代物只有两种结构的有机物的结构简式:__________。
(6)以苯酚为基础原料经三步反应合成解热镇痛药扑热息痛: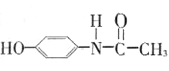
正确答案
(1)羧基
(2)氧化反应 ; 取代反应
(3)
(4)A B
(5)4 ;
(6)
解析
解析已在路上飞奔,马上就到!
知识点
13.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
36.请从36~38题中任选一题作答
36.[化学——选修2:化学与技术]
以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选)
A.CH2=CH2+HCl
B.CH3CH2OH+HCl
C.CH3CH3+Cl2
D.CH2=CHCl+H2
由上述四个反应可归纳出,原子经济性高的是( )反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2- 和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式( ),并说明该方法的优点 ( )。
(3)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
活性炭的作用是 ( );O3消毒的优点是( ) A、B中放置的物质名称分别是:A( ) B( ) 。
37.[化学一选修3:物质结构与性质]
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1) 太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如上图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。
(3) Cu单质晶体中原子的堆积方式如上图甲所示,其晶胞特征如上图乙所示,原子之间相互位置关系的平面图如上图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4)设Cu晶体的密度为
(5)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
38.[化学——选修5:有机化学基础]
已知碳碳双键可以被臭氧氧化:
有机物A可以发生如下图所示的变化,其中E不能发生银镜反应,D能发生银镜反应,1molD与足量的新制的银氨溶液反应最多可产生4mol的银;M的分子内含有七元环状结构。
(1)A的结构简式_______________________________。
(2)A~M中,互为同系物的是____________(填字母代号)。
(3)B的同分异构体中,具有链状结构(即不是环状结构,可以有支链)的酯类物质有_____种,请写出其中一种物质的结构简式____________。
(4)写出下列反应的化学方程式。
①F→G:____________ 。
②C+L→M:____________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析