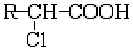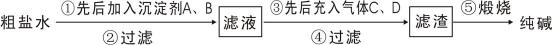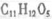- 有机物的结构式
- 共108题
请考生从给出的3道化学题中任选一题做答。
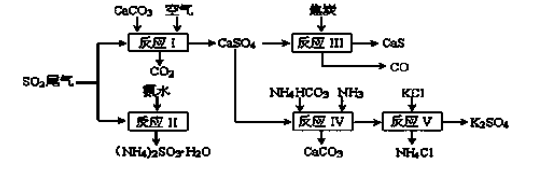
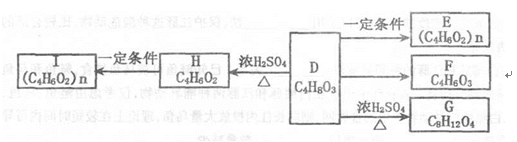
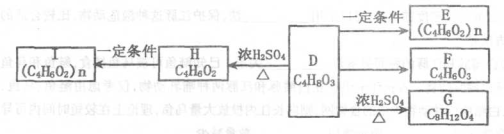
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
( ) 。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。
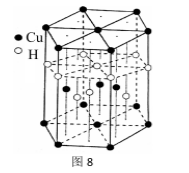
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。
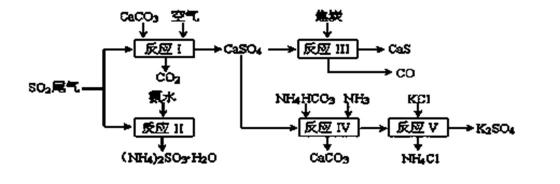
36. 以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
。
(3)下列有关说法正确的是 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是 。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式 。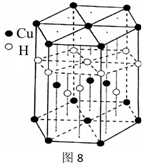
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸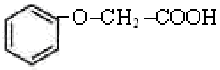
(1)甲一定含有的官能团的名称是 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C
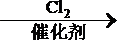
R-ONa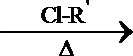
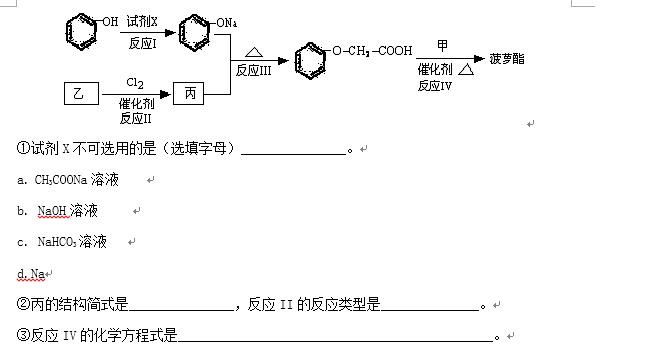
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ,反应II的反应类型是 。
③反应IV的化学方程式是 。
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答。
36.【化学—选修2化学与技术】(15分)
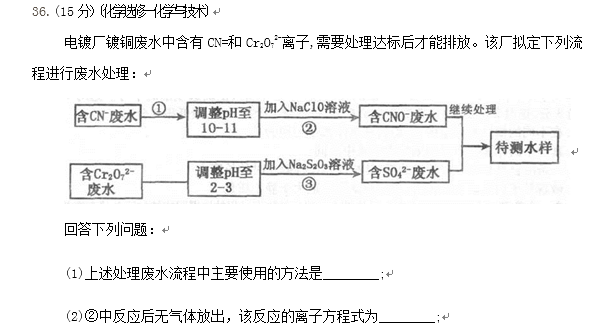
工业生产纯械的工艺流程示意图如下
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式( )。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是( ) (填化学式),原因是
(3)通入C和D气体后发生反应的化学方程式是 ( ) 。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品 ( )(填写化学式),
通氨气与加入细小食盐颗粒的作用是 ( ) 。
(5)写出⑤锻烧发生反应的化学方程式 ( )
产品纯碱中含有碳酸氢钠。若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)= __________________
[加热前后的质量分别用m(加热前)和m(加热后)表示]
37.【化学——选修物质结构与性质】(15分)元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为 ( ),该元素的名称是( );
(2)在X与Z形成的化合物XZ3中,X的杂化类型是 ( ),该化合物的空间构型为_______;短周期元素形成的化合物中与XZ3互为等电子体的是 ( );
(3)请写出X的两种含氧酸的化学式( ) 、( ),其中酸性较强的是( ) 。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为( ) 。
38 【化学——选修有机化学基础】(15分)有机物X、Y、Z都是芳香族化合物,X与Z互为同分异构体,Y的分子式为C9H8O,试回答下列问题。
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氯化碳溶液褪色,且苯环上只有一个取代基。Y的分子中所含官能团的名称 ( ) 。
(3)Z可由A经一步反应制得。
①Z的结构简式为 ( ) 或 ( ) ,写出其中一种结构简式与乙醇发生酯化反应的化学方程式 ( )。
②Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链的同分异构体有 种,写出其中一种同分异构体的结构简式 ( ) 。
36.【化学—选修2化学与技术】(15分)
工业生产纯械的工艺流程示意图如下
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式 。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是 (填化学式),原因是
(3)通入C和D气体后发生反应的化学方程式是 。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品 (填写化学式),
通氨气与加入细小食盐颗粒的作用是 。
(5)写出⑤锻烧发生反应的化学方程式
产品纯碱中含有碳酸氢钠。若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)= __________________
[加热前后的质量分别用m(加热前)和m(加热后)表示]37.【化学——选修物质结构与性质】(15分)元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是 ,该化合物的空间构型为_______;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式 、 ,其中酸性较强的是 。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。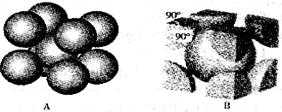
(1)X是一种重要的医药中间体,结构简式为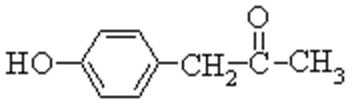

(2)有机物Y有如下转化关系:,
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氯化碳溶液褪色,且苯环上只有一个取代基。Y的分子中所含官能团的名称 。
(3)Z可由A经一步反应制得。
①Z的结构简式为 或 ,写出其中一种结构简式与乙醇发生酯化反应的化学方程式 。
②Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链的同分异构体有 种,写出其中一种同分异构体的结构简式 。
正确答案
10.下列有关化学用语使用正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36. 【化学----化学与技术】(15分)
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用。可利用化工厂生产硼砂的废渣M(主要成分是MgCO3,还含有MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等杂质)来制取七水硫酸镁。已知:
表1 部分阳离子以氢氧化物形式完全沉淀时的pH
表2 盐的溶解度(单位为 g/100g水)
由废渣M制取七水硫酸镁的工艺流程如下:
回答下列问题:
(1)过滤I的滤液中加入NaClO溶液的目的是 ,
写出反应的离子方程式 ,需要加热煮沸的目的是 。
(2)操作Ⅱ所用的玻璃仪器是 。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+,其实验方法是 。
(用离子方程式表示).
(4)沉淀C的化学式是 ,过滤Ⅲ需趁热过滤的理由是 。37.【化学——物质结构与性质】(15分)
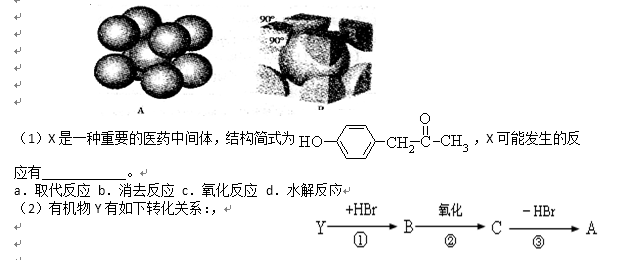
下图是C60、硅、干冰和砷化镓的晶体结构或分子模型。
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式: 。
(2)从晶体类型来看,C60(如图甲)属于 晶体。
(3)二氧化硅结构跟晶体硅(如图乙)的结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙晶体硅的结构,结合题中所给二氧化硅的结构信息,分析晶体二氧化硅中硅原子与共价键的个数比为 。
(4)图丙是干冰的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有 个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为 。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷和丙烯分子中2号碳原子的杂化方式分别是 和 。
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,图丁的砷化镓晶胞。试回答下列问题:
①下列说法正确的是 (填序号)。
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
(3)步骤③中,每处理O.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为________
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:____
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 .7H2O将Cr2O72-还原成Cr3+,调节PH,Fe,Cr转化成相当于: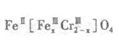
A. x =0.5 ,a =8 B. x =0.5 ,a = 10
C. x = 1.5 ,a =8 D.x = 1.5 ,a = 10
37.(15分)〔化学选修一物质结构与性质〕
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道 有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电 子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最 高的;F2+离子核外各亚层电子均已充满。
根据以上信息回答下列问题:
(1)写出D原子核外电子排布式____________;
(2)A、B、C、D的第一电离能由小到大的顺序为________;(用元素符号表示)
(3)B的氯化物的熔点比D的氯化物熔点____;(填“高”或“低”)理由是____;
(4)E的最高价氧化物分子的空间构型是____;是____分子;(填“极性”或“非极性”)
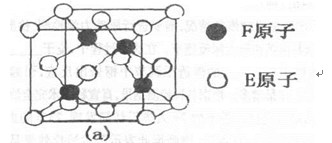
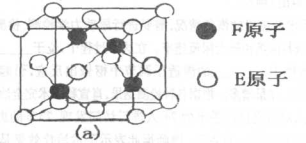
(5)E、F形成的某种化合物有如图所示的两种晶体结构:
该化合物化学式为____;(a)中E原于配位数为____。
38.(15分)[化学选修一有机化学基础〕
两祌有机物A、B分子式均为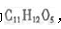
巳知:①A、B、C、D能与NaHCO3反应;
②只有A、C能与FeCl3溶液发生显色发应,且核磁共振氢谱显示苯环上有二种不同 化学环境的氢原子。
③H能使溴水褪色且不含有甲基。
④F能发生银镜反应。
D能发生如下变化:
(1)D→H的反应类型____;D中官能团名称: ________;
(2)写出C的结构简式____;
(3)D→G的反应方程式:________;
(4)B在NaOH溶液中共热的反应方程式:________;
(5)C的同分异构体有多种,写出同时满足下列三个条件的同分异构体结构式:
①苯环上一卤代物只有二种;②能与FeCl3溶液发生显色反应;③能发生银镜反应。
__________、____________________、______________
36.(15分)〔化学选修一化学与技术〕
电镀厂镀铜废水中含有CN=和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流 程进行废水处理:
回答下列问题:
(1)上述处理废水流程中主要使用的方法是________;
(2)②中反应后无气体放出,该反应的离子方程式为________;
(3)步骤③中,每处理O.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为________
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:____
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 .7H2O将Cr2O72-还原成Cr3+,调节PH,Fe,Cr转化成相当于: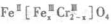
正确答案
扫码查看完整答案与解析