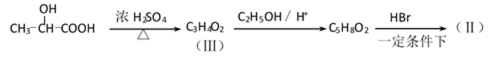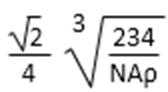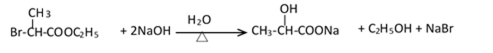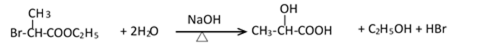- 化学键与物质的性质
- 共213题
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有:________。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b. 晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c. 晶体的熔点:金刚石< 石墨
d. 晶体中共价键的键角:金刚石>石墨
(2)某石蕊的分子结构如图所示。
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是________(填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是________(填化学式);
②该石蕊易溶解于水,分析可能的原因是 ________;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a. 离子晶体
b. 分子晶体
c. 原子晶体
d. 金属晶体
②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中Cu原子的配位数为________。
正确答案
(1)ac
(2)①C、O;H3O+;②该石蕊分子中含有—OH和—NH2,均能与H2O形成氢键;由结构知,该分子为极性分子,根据相似相溶原理,易溶于水。
(3)① abd;②面心立方堆积;12
解析
略。
知识点
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如右图所示。
(1)此配合物中,铁离子的价电子排布式为_________。
(2)此配离子中含有的作用力有_________(填序号)。
A. 离子键
B. 金属键
C. 极性键
D. 非极性键
E. 配位键
F. 氢键
G. 
H. 
(3)此配合物中碳原子的杂化轨道类型有_________。
元素A的基态原子占据纺锤形原子轨道的电子总数为2,元素B与A同周期,其基态原子占据s轨道的电子数与p轨道相同;C是A的同族相邻元素,电负性小于A;D是B的同族相邻元素,第一电离能小于B。
(4)化合物CA和DB2的晶体熔点较高的是_________(填化学式)。
(5)AD2分子的空间构型为_________。
(6)A、B和C的成键情况如下:
A和B之间易形成含有双键的AB2分子晶体,而C和B之间则易形成含有单键的CB2原子晶体,请结合数据分析其原因为_________。
正确答案
(1)3d5
(2)CDEGH
(3)sp2、sp3
(4)SiC
(5)直线形
(6)碳和氧之间形成含有双键的分子放出的能量(803×2=1606kJ·mol-1)大于形成含单键的原子晶体放出的能量(360×4=1440 kJ·mol-1),所以二氧化碳易形成含有双键的分子;氧和硅之间形成含有双键的分子放出的能量(640×2=1280 kJ·mol-1)小于形成含单键的原子晶体放出的能量(464×4=1856 kJ·mol-1),所以二氧化硅易形成含有单键的原子晶体
解析
略。
知识点
下列表达式正确的是
正确答案
解析
略
知识点
请考生从给出的3道物理题中任选一题做答。
36.[化学——选修2:化学与技术]
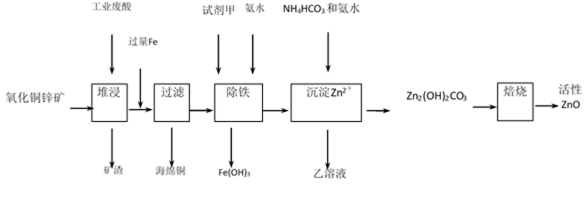
某工厂利用工业废酸(10%H2SO4)堆浸某废弃的氧化铜锌矿制取活性ZnO, 方案如下:
已知:298K时各离子开始沉淀及完全沉淀时的pH:
(1) 氧化铜锌矿中含有少量CuS和ZnS,在稀H2SO4作用下ZnS可溶而CuS不溶,这是由于同温下
Ksp (ZnS) _________Ksp (CuS)(">" “<”,或“=”)。
(2) 在除铁过程中选用下列试剂中的_________作为试剂甲最合适:
A. Cl2
B. HNO3
C. KMnO4
D. H2O2
(3) 除铁过程中加入氨水的目的(),实验中PH应控制的范围();
(4) 加试剂甲后,Fe3+,与氨水生成Fe(OH)3的离子方程式();
(5) 298K时,检验乙溶液中是否残留较多Fe3+的方法();
(6)乙的溶液可直接用作氮肥,乙的化学式();
(7)Zn2(OH)2CO3焙烧的化学方程式()。
37.[化学——选修3:物质结构与性质]
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子云相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)己知A元素扣一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______
(3)己知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。
四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
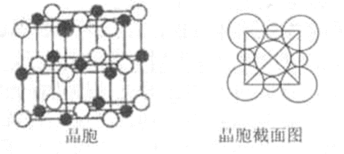
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构, 它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。
若晶体密度为
(用含NA与
38.[化学——选修5:有机化学基础]
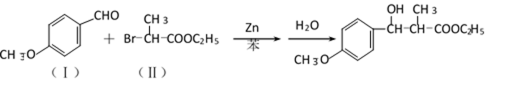
有机合成中增长碳链是一个重要环节。如下列反应:
用
(1)(Ⅰ)的分子式为();(Ⅲ)的结构简式为()。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为()。
(3)
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。(Ⅳ)的结构简式为()。
正确答案
见解析。
解析
36.
(1)> (2) D
(3)调节溶液的pH,使Fe3+沉淀完全, 3.2~6.2
(4)Fe3++3NH3·H2O === Fe(OH)3↓+3 NH4+
(5)取少量乙溶液于试管中,滴入几滴KSCN溶液,若出现红色,说明还有较多Fe3+,若无红色出现,说明Fe3+沉淀完全,
(6)(NH4)2SO4
(7)Zn2(OH)2CO3 == 2ZnO+CO2↑ + H2O(2分)
37.
(1)[Ar]3ds1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na,NaOH > H3PO4 >HClO4>H2SO4
(5)12
38.
说明;所有的化学方程式或结构简式写成一般结构简式或键线式同样得分;化学方程式没有注明反应条件或条件错误扣1分,化学式错误和不配平0分,下同。
(1)C8H8O2 ;CH2=CH-COOH
(2)
或
(3) 
取代反应(或酯化反应)
(4)
知识点
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类 1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成下面两题:
(1)下列关于天然气水合物中两种分子描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.H2O是极性分子,CH4是非极性分子 D.其中氧原子和碳原子的杂化方式分别为sp2和sp3
E.其中氧原子和碳原子的杂化方式均为sp3
(2)晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
II、A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小。A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1︰1组成化合物Z。
(3)写出Z的电子式
(4)C元素焰色反应的颜色为 试从原子结构的角度解释其原因
(5)B、C、D可组成离子化合物CmDBn,其晶体结构单元如右图所示。阳离子Cx+(○表示)位于正方体的棱的中点和正方体内部(内部有9个○,1个位于体心,另8个位于大正方体被等分为8个小正方体后的体心);阴离子DBnmx-(●表示)位于该正方体的顶点和面心。则:x= 、m= 、n= 。已知该晶体的密度为a g/cm3 ,则该晶体
正确答案
中阳离子间的最近距离为
(1)CE
(2)CH4·8H2O或6CH4·48H2O
(3)
(4)黄色;在加热的条件下钠原子的核外电子吸收能量,电子从基态跃迁到激发态,电子处于激发态不稳定又重新跃迁到基态,在此过程中以光波的形式释放能量。
(5)1;3;6;
解析
略
知识点
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为 。
(2)As基态原子核外M层电子的排布式为 。
(3) 从化合物NF3和 NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是
。
②NH3易与Cu2+反应,而NF3却不能,其原因是
。
③NF3分子极性小于NH3,其原因是
。
(4)白磷(P4)分子的空间构型为
(5)最简单的二元硼氮化合物可以通过下列反应合成:
B2O3(l)+2NH3(g)
反应产生的氮化硼的结构与石墨结构相类似(见图1),其晶胞构型如图2(即为层状六方氮化硼的晶胞)。层内B-N核间距为145pm,面间距为333pm。在高压(60kbar)、高温(2000℃)下,层状六方氮化硼晶体可转化为立方氮化硼,它与金刚石有类似结构(见图3)。请回答下列问题:
①层状六方氮化硼晶体和立方氮化硼晶体中B原子杂化类型分别为 。
②层状六方氮化硼晶体的密度 。(只需要列出计算式,不需计算出结果)
正确答案
(1)N>P>As
(2)3s23p63d10
(3)①NH3分子间存在较强的氢键,而NF3分子间仅有较弱的范德华力
②NF3中F的高电负性,降低了N的最外层孤对电子云密度,所以NF3不能与Cu2+形成稳定配位键。
③两者结构相似,但F的电负性比N大而H电负性比N小。负电荷主要在两对孤对电子处。在NH3分子中N从H吸电子,这个因素产生的极性和孤对电子的效果相同,极性叠加;而NF3分子中F从N吸电子的效果和孤对电子的效果是相反的,极性部分抵消。所以NH3的极性明显强于NF3 。
(4)正四面体 ; 正八面体 ;
(5)① sp2 ; sp3
②ρ=
解析
略
知识点
请考生从给出的3道化学题中任选一题做答。
36.某工厂利用工业废酸(10%H2SO4)堆浸某废弃的氧化铜锌矿制取活性ZnO, 方案如下:
已知:298K时各离子开始沉淀及完全沉淀时的pH:
(1) 氧化铜锌矿中含有少量CuS和ZnS,在稀H2SO4作用下ZnS可溶而CuS不溶,这是由于同温下Ksp (ZnS) _________Ksp (CuS)(">" “<”,或“=”)。
(2) 在除铁过程中选用下列试剂中的_________作为试剂甲最合适:
A. Cl2
B. HNO3
C. KMnO4
D. H2O2
(3) 除铁过程中加入氨水的目的 ___________ ,实验中PH应控制的范围 ___________ ;
(4) 加试剂甲后,Fe3+,与氨水生成Fe(OH)3的离子方程式 ___________ ;
(5) 298K时,检验乙溶液中是否残留较多Fe3+的方法 ___________ ;
(6)乙的溶液可直接用作氮肥,乙的化学式 ___________;
(7) Zn2(OH)2CO3焙烧的化学方程式 ___________。
37.已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子云相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)己知A元素扣一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)己知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。
四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构, 它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。
若晶体密度为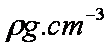
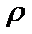
38.有机合成中增长碳链是一个重要环节。如下列反应:
用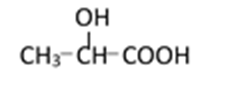
(1)(Ⅰ)的分子式为___________;(Ⅲ)的结构简式为___________ 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为___________ 。
(3)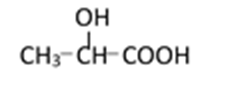
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。(Ⅳ)的结构简式为 ___________。
正确答案
见解析。
解析
36.(1)>
(2) D
(3)调节溶液的pH,使Fe3+沉淀完全, 3.2~6.2
(4)Fe3++3NH3·H2O === Fe(OH)3↓+3 NH4+
(5)取少量乙溶液于试管中,滴入几滴KSCN溶液,若出现红色,说明还有较多Fe3+,若无红色出现,说明Fe3+沉淀完全 ,
(6)(NH4)2SO4
(7)Zn2(OH)2CO3 == 2ZnO+CO2↑ + H2O
37.(1)[Ar]3ds1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na,NaOH > H3PO4 >HClO4>H2SO4
(5)12;
38.(1)C8H8O2 ;CH2=CH-COOH
(2)
或
(3) 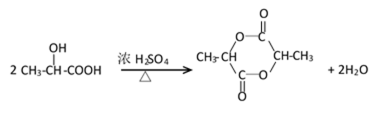
取代反应(或酯化反应)
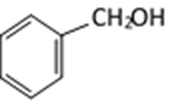
(4) 
知识点
化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答:
(1)与(HB=NH)3互为等电子体的分子为 (填分子式)。
(2)下列关于合成A的化学方程式的叙述不正确的是 (填选项字母)。
a.反应前后碳原子的轨道杂化类型不变
b.CH4、H2O、CO2的分子空间构型分别为正四面体形、V形、直线形
c.第一电离能的大小关系为:N>O>C>B
d.A中存在配位键
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有
个硼原子, 个氮原子。
(4)人工可以合成硼的一系列氮化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6) ,同时生成另外两种产物,该反应的化学方程式为 。
(5)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,其原因为
(6)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为 ;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型 。
正确答案
(1)C6H6
(2)a
(3)4 ; 4
(4)3LiAlH4+4BF3
(5)B—O键键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键
(6)[BO2]nn-或BO2- ; sp2、sp3
解析
略
知识点
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S三种元素的第一电离能从大到小的顺序为________。
(2)甲醛(H2C=O)分子碳原子的杂化方式为________用价层电子对互斥理论推断甲醛中H—C—H的键角________120o(填 “>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是________。
设MgO晶胞的边长为acm,则MgO的密度是________g·cm-3(只要求列算式。阿伏伽德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内不含有________(填字母)。
A.离子键
B.共价键
C.金属键
D.配位键
E.氢键
F.Π键
正确答案
(1)N>O>S
(2)sp2;<
(3)MgO>CaO>KCl
(4)160/a3 NA
(5)AC
解析
(1)根据同周期同主族元素性质递变规律判断,同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S。
(2)甲醛(H 2 C=O)分子碳原子的杂化方式为sp2;甲醛(H 2 C=O)分子中氧原子上含有两对孤对电子,对成键电子对有排斥作用,甲醛中H—C—H的键角<120o 。
(3)对于结构相似的离子晶体,晶格能越大晶体的熔点越高;晶格能的高低取决于离子半径和离子所带的电荷,离子半径越小,所带电荷越多,晶格能越大,熔点越高;则KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是MgO>CaO>KCl。
(4)根据MgO晶胞结构利用切割法分析知,1mol晶胞中含有4molMgO,质量为160g,晶胞的边长为acm,则1mol晶胞的体积为a3NAcm3则MgO的密度是160/a3NAg·cm-3 。
(5)根据配合物的分子结构判断,其分子内不含有离子键和金属键,选AC。
知识点
铜的化合物是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。请回答下列问题:
(1)与铜同周期的所有元素的基态原子中,未成对电子数与铜相同的元素有________种。Cu+的电子排布式是________。
(2)配离子[Cu(NH3)4(H2O)2]2+的Cu(Ⅱ)的配位数为________,该微粒含有的微粒间的作用力类型有________(填字母);
A.配位键
B.离子键
C.极性共价键
D.氢键
E.金属键
F.σ键
H、N、O三种元素的电负性由大到小的顺序是________。
(3)EDTA(
(4)CuCl的晶胞结构如图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为________。
正确答案
(1)3;1s22s22p63s23p63d104s0
(2)6;ACF;ONH
(3)sp2 、sp3
(4)4
解析
略。
知识点
扫码查看完整答案与解析