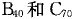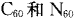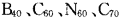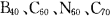- 化学键与物质的性质
- 共213题
7.中新网报道美国准备试验绿色航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全.环保,预计最早将在今年进行卫星飞行试验。羟基硝酸铵的结构如图所示,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.“富勒烯”家族又增添了新成员,继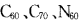
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.在下列指定条件的溶液中,一定能大量共存的离子组是
正确答案
解析
A. K2S溶液中的硫离子与铜离子反应生成硫化铜沉淀,故不共存;
B. Fe2+与ClO-能够发生氧化还原反应,不共存,故不共存;
C.常温下,
D. 滴入KSCN溶液显血红色的溶液中含有三价铁离子,三价铁离子与C6H5OH发生反应,故不共存;
考查方向
解题思路
本题考查了离子的共存,题目难度不大,熟悉离子反应的条件是解题关键,注意离子的类型。离子之间能够发生反应就不共存,离子反应的条件为:能够生成沉淀、产生气体、生成弱电解质的离子;具有强氧化性的离子与强还原性离子,能够发生氧化还原反应的离子;能够强氧化性的离子与强还原性离子;能够发生络合反应的离子,上述离子在溶液中因为能够发生离子反应而不共存,据此解答.
易错点
1、强氧化性的离子与强还原性离子的区分。
2、强氧化性的离子与强还原性离子的区分。
知识点
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
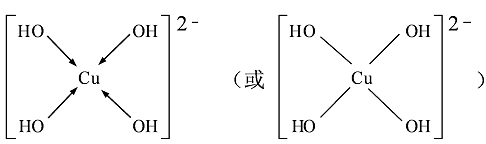
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
正确答案
见解析。
解析
(1)①1s22s22p63s23p63d5(或[Ar]3d5)
②平面三角形
(2)①C≡O ②sp3 ③2×6.02×1023个(或2mol)
(3)
本题科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、[Cu(OH)4]2-结构等《选修三》基础知识的掌握和应用能力。本题基础性较强,重点特出。
知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ2-
①YZ2-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
正确答案
见解析。
解析
(1)①4 ②ZnS
(2)sp3
(3)水分子与乙醇分子之间形成氢键
(4)① 正四面体 ②CCl4 或SiCl4 等
(5)16 mol 或16伊6. 02×1023个
知识点
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是
正确答案
解析
本题考查分子结构、氧化还原反应以及阿伏伽德罗常熟等知识。
A错在N-O键为极性键;

知识点
(1)下列分子中,属于非极性的是_______。
A. SO2
B. BeCl2
C. BBr3
D. COCl2
(2)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为_______;
2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
3)SO42-的立体构型是_______,其中S原子的杂化轨道类型是_______;
4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为_______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是_______;
5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_______。
正确答案
(1)BC
(2)1)Cu+2H2SO4(浓)
解析
(1)根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下:
(2)本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。3)硫酸根中心原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;4)Au电子排布或类比Cu,只是电子层多两层,由于是面心立方,晶胞内N(Cu)=6×

知识点
下列化合物分子中的所有原子都处于同一平面的是
正确答案
解析
A选项,苯环为平面结构,溴原子取代苯环上的一个氢原子后,与苯环在同一平面上,则溴苯为平面结构;B选项,甲基为空间立体结构;C选项,乙烯为平面结构,氯原子取代乙烯的一个氢原子后,仍为平面结构;D选项,丙烯含有甲基,甲基为空间立体结构。
知识点
短周期主族元素A、B、C、D的原子序数依次增大,它们的原子核外电子层数之和为7。B的化合物种类繁多,数目庞大。A与D能形成原子个数比为1︰1和2︰1的化合物。
(1)人类六大营养素中,只由A、B、D三种元素组成的有 (填其中一种营养素的名称);只由A、B、D三种元素组成的化合物中,相对分子质量最小的是 ;
由A、B、C三种元素按原子数目比5︰1︰1组成分子E,请写出E的电子式__________。
(2)由A、C两种元素组成的一种常见气态化合物,其分子的空间构型为________,工业上合成该气体的化学方程式为 。
(3)只由A、C、D组成的盐,发生水解反应的离子方程式为 。
(4)甲、乙两种化合物都只由A、B、C、D四种元素组成,它们既能与盐酸反应又能与烧碱溶液反应。其中,甲为无机酸式盐,甲与稀烧碱溶液反应的离子方程式为 ;乙为天然蛋白质水解的相对分子质量最小的产物,其结构简式为 。
正确答案
见解析。
解析
(1) 糖类(或:油脂); HCHO(或:甲醛) ; 
(2)三角锥型 ; 
(3)
(4)

知识点
扫码查看完整答案与解析