- 化学键与物质的性质
- 共213题
11.下列有关物质性质的比较,错误的是( )
正确答案
解析
在碳酸钠饱和溶液中通入二氧化碳生成碳酸氢钠,可观察到溶液变浑浊,说明碳酸钠溶解度大于碳酸氢钠,故A正确;
卤代烃的密度比水大,则溴乙烷的密度大于水,故B正确;
晶体硅与金刚石都为原子晶体C﹣C>Si﹣Si,原子晶体中,键长越短,键能越大,则硬度越大,故C正确;
苯中碳碳键介于单键和双键之间,碳碳键键长:乙烯<苯,故D错误.
考查方向
解题思路
相同条件下,碳酸钠溶解度大于碳酸氢钠;
卤代烃的密度比水大;
原子晶体中,键长越短,键能越大,则硬度越大;
苯中碳碳键介于单键和双键之间.
易错点
本题考查元素及其对应单质、化合物的性质的递变规律,侧重于溶解度、硬度、密度等性质的考查,题目难度不大,注意把握性质比较的角度以及规律.
知识点
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
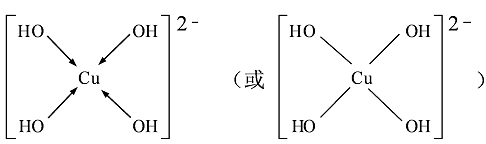
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
正确答案
见解析。
解析
(1)①1s22s22p63s23p63d5(或[Ar]3d5)
②平面三角形
(2)①C≡O ②sp3 ③2×6.02×1023个(或2mol)
(3)
本题科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、[Cu(OH)4]2-结构等《选修三》基础知识的掌握和应用能力。本题基础性较强,重点特出。
知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
25.回答下列问题:
(l)已知

(2)Mg存在于叶绿素中,某些作物生长时需要输镁肥,从海水中提取镁是获得镁的主要来源。常温下,已知Mg(OH)2的Kap=l.6x10-11,某浓缩海水中Mgcl2浓度为1.6xl0一3mol/L,则要使Mg2+形成Mg(OH)2沉淀,则溶液的pH至少要达到 。
(3)将A(g)和B(g)按物质的量比为1:1通入到体积为2L的恒容密闭容器中,进行反应A(g)+B(g)
①上述反应为 (填“吸热”或“放热”)反应;
②计算在650℃下,从开始到平衡的反应速率v(A)=
③在900℃下该反应的平衡常数为 (保留三位有效数字),若平衡后保持温度不变向容器中继续充入2molA、lmolM和lmolN,这时平衡移动 (填“正向”、“逆向”、“不”);
④若650℃时,在同样容器中起始时充入的A和B的物质的量均为 2mol,则下图中 是B物质平衡时对应的点。
正确答案
解析
(1)设断开P-P键吸收的能量为x, 6x+3×498-12×360 =- 1632 X=199
(2)Ksp=c(Mg2+)xc2(OH-)=1.6xl0一3mol/L x c2(OH-)= l.6x10-11
c(OH-)= l0一4 mol/L PH=10
(3)①、由图像可知,温度升高,B的物质的量增多,说明平衡逆移,反应放热。
②、由图可知650℃下,从开始到平衡的时间为5min,B变化的物质的量浓度为(4-1)mol/2L=1.5mol/L
v(A)=v(B)=1.5mol/L÷5min=0.3mol/(L.min)
③、900℃ A(g)+B(g)
起始浓度(mol/L) 2 2 0 0
变化浓度(mol/L) 1.25 1.25 1.25 1.25
平衡浓度(mol/L) 0.75 0.75 1.25 1.25
K=2.66
通入2molA、lmolM和lmolN Qc=1.4< K 平衡正移
④、650℃时,在同样容器中起始时充入的A和B的物质的量均为 2mol,压强减小,但该反应是反应前后气体分子数目不变的反应,压强变化平衡不移动,反应速率减慢。B的量所谓原来的一半为0.5mol,到达平衡的需要的时间长,为c点
考查方向
本题考查了化学平衡常数的计算以及应用,平衡移动的影响因素,溶度积常数的应用,键能的计算等知识点。
解题思路
见解析。
教师点评
本题考查了化学平衡常数的计算以及应用,平衡移动的影响因素,溶度积常数的应用,键能的计算等知识点。以及学生的计算能力,图像分析能力等,在高考中出现频率高。
知识点
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ2-
①YZ2-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
正确答案
见解析。
解析
(1)①4 ②ZnS
(2)sp3
(3)水分子与乙醇分子之间形成氢键
(4)① 正四面体 ②CCl4 或SiCl4 等
(5)16 mol 或16伊6. 02×1023个
知识点
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是
正确答案
解析
本题考查分子结构、氧化还原反应以及阿伏伽德罗常熟等知识。
A错在N-O键为极性键;

知识点
(1)下列分子中,属于非极性的是_______。
A. SO2
B. BeCl2
C. BBr3
D. COCl2
(2)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为_______;
2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
3)SO42-的立体构型是_______,其中S原子的杂化轨道类型是_______;
4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为_______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是_______;
5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_______。
正确答案
(1)BC
(2)1)Cu+2H2SO4(浓)
解析
(1)根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下:
(2)本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。3)硫酸根中心原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;4)Au电子排布或类比Cu,只是电子层多两层,由于是面心立方,晶胞内N(Cu)=6×

知识点
下列化合物分子中的所有原子都处于同一平面的是
正确答案
解析
A选项,苯环为平面结构,溴原子取代苯环上的一个氢原子后,与苯环在同一平面上,则溴苯为平面结构;B选项,甲基为空间立体结构;C选项,乙烯为平面结构,氯原子取代乙烯的一个氢原子后,仍为平面结构;D选项,丙烯含有甲基,甲基为空间立体结构。
知识点
短周期主族元素A、B、C、D的原子序数依次增大,它们的原子核外电子层数之和为7。B的化合物种类繁多,数目庞大。A与D能形成原子个数比为1︰1和2︰1的化合物。
(1)人类六大营养素中,只由A、B、D三种元素组成的有 (填其中一种营养素的名称);只由A、B、D三种元素组成的化合物中,相对分子质量最小的是 ;
由A、B、C三种元素按原子数目比5︰1︰1组成分子E,请写出E的电子式__________。
(2)由A、C两种元素组成的一种常见气态化合物,其分子的空间构型为________,工业上合成该气体的化学方程式为 。
(3)只由A、C、D组成的盐,发生水解反应的离子方程式为 。
(4)甲、乙两种化合物都只由A、B、C、D四种元素组成,它们既能与盐酸反应又能与烧碱溶液反应。其中,甲为无机酸式盐,甲与稀烧碱溶液反应的离子方程式为 ;乙为天然蛋白质水解的相对分子质量最小的产物,其结构简式为 。
正确答案
见解析。
解析
(1) 糖类(或:油脂); HCHO(或:甲醛) ; 
(2)三角锥型 ; 
(3)
(4)

知识点
氮族元素化合物在医药、纳米材料制备中应用广泛。
40.P元素的基态电子电子排布式为
41.白磷的分子式为P4,其结构如下图所示,科学家目前合成了 N4分子, N 原子的杂化轨道类型是 ,N—N—N 键的键角为 ;
42.N、P、As原子的第一电离能由大到小的顺序为 。
44.立方氮化硼晶体的结构如下图所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是 ;立方砷化镓晶体的晶胞边长为a pm,则其密度为 g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
正确答案
1s22s22p63s23p3 或Ne3s23p3
解析
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式为1s22s22p63s23p3
故答案为:1s22s22p63s23p3
考查方向
解题思路
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式
易错点
书写电子排布式的方法不掌握
正确答案
sp3 60°
解析
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式为sp3;该分子结构和白琳分子结构相同,为正四面体结构,键角为60度。
考查方向
解题思路
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式;该分子结构和白琳分子结构相同,为正四面体结构
易错点
杂化类型不会判断
正确答案
N>P>As
HNO3 NO3— V形
解析
同主族元素,元素第一电离能随着原子序数增大而减小,故第一电离能N>P>As
故答案为:N>P>As
[来源:学.科.网Z.X43.HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 ,酸根中没有孤对电子的是 ,NO2—空间构型是 。
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

故答案为HNO3 NO3— V形
考查方向
解题思路
同主族元素,元素第一电离能随着原子序数增大而减小;
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

易错点
第一电离能变化规律未掌握
不会通过计算发法推断出空间构型
正确答案
氮化硼(或BN) 5.8×1032/NA·a3
解析
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,故氮化硼熔点更高;晶胞中 As、Ga原子数目均为4,晶胞质量为
故答案为:5.8×1032/NA·a3
考查方向
解题思路
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据密度共识进行计算
易错点
不会利用密度公式进行晶胞的基本计算
扫码查看完整答案与解析