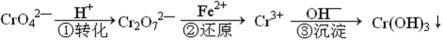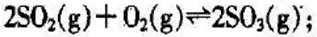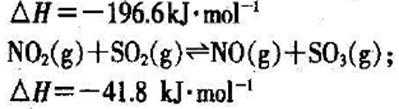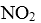- 化学平衡状态的判断
- 共46题
10.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是()
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是________。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为: ___________ 。
正确答案
(1) BC
(2)
① 大于
② 升高温度 增大压强
③
④
K = c(CH3OH)×c(H2O)/ c(CO2)×c3(H2)
=1 (mol / L ) ·1 (mol / L )/ 13 (mol / L )· 2(mol / L )=0.5L-2 / mol-2
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
解析
略
知识点
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 
正确答案
解析
略。
知识点
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+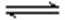
(1) 若平衡体系的pH=2,则溶液显 ___________ 色.
(2) 能说明第①步反应达平衡状态的是 ____________ 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变 d. 溶液的pH值不变
(3) 第②步中,还原0.01mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4) 许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2—(亮绿色) + H2O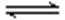
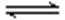
下列有关说法中正确的是
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2—)
b、在一定条件下存在:Cr(OH)3 + OH— → CrO2— + 2H2O ;Cr(OH)3 + 3H+ → Cr3+ + 3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
正确答案
(1)橙
(2)cd
(3)0.06
(4)ab
解析
略
知识点
在三种不同条件下,分别向容积为2L的恒容容器中加入2molA和1molB,发生反应如下:2A(g)+B(g) 
正确答案
解析
略。
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是()
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率()逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是(),曲线Ⅱ对应的实验条件改变是()。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为()。
正确答案
见解析。
解析
(1) BC(3分,只选B或C得1分,全对得3分,凡其它有错答案不得分)
(2) ① 大于② 升高温度 增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O( 2分,未配平扣1分)
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是_________。
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率_________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_________ 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_________ 。
正确答案
见解析。
解析
(1) BC
(2) ① 大于;
② 升高温度 ;增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
知识点
X是一种重要的工业原料, X在160℃分解制备异氰酸和氨气,反应方程式为:
X 
(1)在上述反应所涉及的各元素中,原子半径最大的元素是_________,其原子核外电子共占据_______个轨道。
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素非金属性递变规律的事实是____________。
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:
2NH3(g)+NO(g)+NO2(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=__________mol/L·min。
(4)当该反应达到平衡时,下列说法一定错误的是___________。
a.气体密度不变
b.气体颜色不变
c.υ(NO)正= 2υ(N2)逆
d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如右图所示,X电子式为______________。
(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出氰酸和异氰酸的结构式:_______________、______________。
正确答案
(1)C,4个
(2)c
(3)0.005mol/(L·min)
(4)c
(5)
(6)
解析
略
知识点
29.硫酸生产过程中关键阶段的反应为:



(1)能判断该反应达到化学平衡状态的依据是( )
A.容器中气体密度保持不变
B.混合气体中
C.
D.
(2)反应达到平衡时,测得

(3)下图A为在不同温度、不同压强下达到平衡时,混合气体中

A.图A中
B.图A中
C.图B为减小体系压强,平衡发生移动, 达到平衡态Ⅱ
D.图B为增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
(4)我国工业制备











正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(1)在一密闭容器中进行如下反应:
①若298K时平衡常数为K;,498K时平衡常数为K2,则K1____K2(填“>”“=”“< ")。
②若保持容器容积不变,则该反应达到平衡状态的标志是____(填选项序号)。
a.2v(H2)正=3v(NH3)逆 b.v(H2)正= 3v(NH3)逆
c.容器内压强保持不变; d.混合气体平均摩尔质量不变
③若保持容器压强不变,达到平衡后,再向容器通入一定量He,此时逆反应速率____;(填“增大”“不变”或“减小”).平衡向____(填“正反应”或“逆反应”)方向移动。
(2)肼(N2H4)是一种高能燃料.298K时,l.00g N2H4(l)与足量的N2O4 (1)反应生成N2(g)和H2O(1)放出19.15KJ的热,写出该反应的热化学方程式:____;
(3)肼也可以在纯氧中燃烧生成Ni和水,某科研所用该反应原理设计制造原电池。电池用多孔石墨作电极,电解质为能传导H+的固体电解质,则该电池负极的反应式为___。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
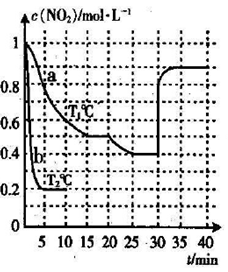
27.在2L的密闭容器内投入一定量NO2,发生反应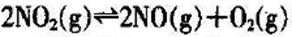
(1)已知:
(2)下列描述中,一定能说明密闭容器中的反应达到平衡状态的是( )(填字母代号)。
A.v(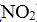
B.混合气体的颜色保持不变
C.密闭容器中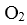
D.密闭容器中NO和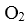
(3)实验a中,从反应开始至第一次刚达到平衡时段,生成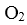
(4)由图像信息推断,T1℃( )T2℃(填“低于”或“高于”),理由是( )。
(5)20-25 min时间段,a曲线变化的可能原因是( )(填字母代号,下同),30-35min时间段.a曲线变化的可能原因是( )。
A.升高温度 B.缩小容器体积 C.降低温度 D.扩大容器体积
E.在恒容条件下充入
(6)若在实验b初始,向该2L密闭容器中通入的是1mol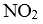
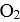
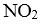
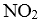
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析